|
Коллагеновая спираль
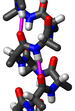
 Тройная спираль коллагена или спираль типа 2 является основной вторичной структурой различных типов волокнистого коллагена, включая коллаген типа I. Он состоит из тройной спирали, состоящей из повторяющейся аминокислотной последовательности глицин -X-Y, где X и Y часто представляют собой пролин или гидроксипролин[2][3]. Коллаген, свернутый в тройную спираль, известен как тропоколлаген. Тройные спирали коллагена часто связаны в фибриллы, которые сами образуют более крупные волокна, как в сухожилиях. СтруктураГлицин, пролин и гидроксипролин должны находиться в назначенных положениях с правильной конфигурацией. Например, гидроксипролин в положении Y увеличивает термическую стабильность тройной спирали, но не в положении X[4]. Термостабилизация также затрудняется, когда гидроксильная группа имеет неправильную конфигурацию. Из-за высокого содержания глицина и пролина коллаген не может образовывать регулярную структуру α-спиралей и β-листов. Три левозакрученных спиральных нити скручиваются, образуя правозакрученную тройную спираль[5]. Тройная спираль коллагена имеет 3,3 остатка на виток[6]. Каждая из трех цепей стабилизируется стерическим отталкиванием за счет пирролидиновых колец остатков пролина и гидроксипролина. Пирролидиновые кольца не мешают друг другу, когда полипептидная цепь принимает эту расширенную спиральную форму, которая намного более открыта, чем плотно скрученная форма альфа-спирали. Три цепи связаны друг с другом водородными связями. Донорами водородной связи являются пептидные NH-группы остатков глицина. Акцепторами водородной связи являются группы СО остатков на других цепях. Группа ОН гидроксипролина не участвует в образовании водородных связей, но стабилизирует транс-изомер пролина за счет стереоэлектронных эффектов, таким образом стабилизируя всю тройную спираль. Размер коллагеновой спирали (суперспирали) составляет 2,9 Å (0,29 нм) на остаток. Центр тройной спирали коллагена очень маленький и гидрофобный, и каждый третий остаток спирали должен контактировать с центром[7]. Из-за очень маленького и тесного пространства в центре только небольшой водород боковой цепи глицина способен с ним взаимодействовать[7]. Этот контакт невозможен, даже если присутствует немного больший аминокислотный остаток, отличный от глицина. Примечания
|
||||||||||||||||||||
![Модель коллагеновой спирали[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/94/1K6F_Crystal_Structure_Of_The_Collagen_Triple_Helix_Model_Pro-_Pro-Gly103_04.png/274px-1K6F_Crystal_Structure_Of_The_Collagen_Triple_Helix_Model_Pro-_Pro-Gly103_04.png)