|
硝酸アンモニウム
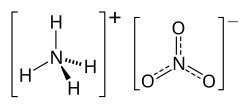
硝酸アンモニウム(しょうさんアンモニウム、英語: ammonium nitrate)とは、化学式NH4NO3で表される化合物であり、アンモニウムおよび硝酸塩のイオンから成っている白い結晶の固体である。硝安とも呼ばれる。 水和物を形作らないが、固体は吸湿性であり、また水溶性が高い。主に高窒素肥料として農業で使用されている[1]。世界の生産量は、2017年に21.6百万トンと推定された。 その他の主な用途は、鉱業、採石、土木建設で使用される爆発性混合物の成分として使用される。ANFOの主要な構成要素であり、北米で使用される爆発物の8割を占める、普及した産業用爆発物である。また同じような調合は、IEDでも使用されてきた。 多くの地域では、誤用の可能性に対する懸念から、消費者向け用途での使用を段階的に廃止している[1]。20世紀初頭以来、偶然による硝酸アンモニウムの爆発のために何千人もの人々が命を落としてきた。 合成硝酸アンモニウムの工業生産は、アンモニアと硝酸の酸塩基反応を伴う。 アンモニアを無水状態(気体)で使用し、硝酸を濃縮する。反応は非常に激しく発熱性である。溶液が形成された後、通常は約83%の濃度で、グレードに応じて95%から99.9%の濃度の硝酸アンモニウム(AN溶融物)を残すために、余分な水分を蒸発させる。AN溶融物は、その後、スプレータワーで「プリル」または小さなビーズにされるか、または回転ドラムで噴霧およびタンブリングする方法により、顆粒にされる。このプリルまたは顆粒は、さらに乾燥させ、冷却させた後、固結を防止するためのコーティングも可能である。これらのプリルまたは顆粒は、商業上の典型的なAN製品である。 このプロセスに必要なアンモニアは、ハーバー・ボッシュ法で窒素と水素から得られる。ハーバー・ボッシュ法で生成されたアンモニアは、オストワルト法(Ostwald process)で硝酸に酸化できる。もう1つの製造方法は、次のニトロリン酸プロセスの変種である。 生成物である炭酸カルシウムと硝酸アンモニウムは、別々に精製しても良いし、硝酸カルシウムアンモニウムとして販売しても良い。 また、硝酸アンモニウムは複分解反応により製造することもできる。 反応加熱するか、もしくは塩化物イオンを触媒とすれば、分解して亜酸化窒素(一酸化二窒素、笑気)を発生する。 さらに、210 ℃ 程度に加熱すると爆発する。 この性質を利用して、木粉、ニトロナフタリンなどを混合したものは硝安爆薬として用いられる。 尿素や硫酸アンモニウムと同様に、硝酸アンモニウムも水に溶解する際は吸熱する。食塩などと比較すると吸熱反応のエネルギーが大きいため、携帯式氷枕(瞬間冷却パック)などの寒剤に使用される。 用途肥料硝酸アンモニウムは、NPKレーティング34-0-0(窒素34%)の重要な肥料である[2]。ただし、尿素(46-0-0)よりも含有される窒素の濃度が低く、硝酸アンモニウムの輸送はわずかに不利である。尿素に対する硝酸アンモニウムの利点は、それがより安定していて、急速に大気に窒素を放出しないという点である。 爆発物通常、発破剤として純粋な形では使用されないが、硝酸アンモニウムは多くの爆薬の成分である。硝酸アンモニウムを含む爆薬の例としては、以下の物が挙げられる。
燃料油との混合物ANFOは94%硝酸アンモニウム(「AN」)と6%燃料油(「FO」)の混合物で、バルク産業用爆薬として広く使用されている。水への耐性、酸素バランス、高い爆発速度および小さい直径性能のような伝統的な産業火薬によって提供される利点ではなく、ANFOの低価格および使用の容易さなどの利点をより活かせる石炭鉱山、採石、金属の鉱山および土木構造などといった、あまり需要の見込めない用途に使用される[3]。 テロ硝酸アンモニウム系の爆薬は、1970年のウィスコンシン州マディソンのスターリングホール爆破事件、1995年のオクラホマシティ連邦政府ビル爆破事件、2011年のデリー爆破事件、2011年のノルウェー連続テロ事件、2013年のハイデラバード爆破事件などで使用されてきた。 2009年11月に、パキスタン北西辺境州(NWFP)政府は、NWFPのアッパーディール、ローワーディール、スワット、チトラール、マラカンドの旧マラカンド師団で硫酸アンモニウム、硝酸アンモニウム、硝酸カルシウムアンモニウム(CAN)の肥料が過激派によって爆発物の製造に使用されたとの報告を受けて、禁止令を出した。これらの禁止令が出た結果、塩素酸カリウム(安全マッチを発火させる物質)は、反政府派による爆発物の選択として、硝酸アンモニウムなどの肥料よりも有利になった[4]。 寒剤硝酸アンモニウムは、水に溶解する際の吸熱性が非常に高く、一部の保冷剤に使用されている。 その他の用途硝酸グアニジン[5][6]のような独立した爆発性を有する「燃料」と組み合わせて、タカタ株式会社が製造したエアバッグのインフレータの5-アミノテトラゾールに代わる安価な(しかし安定性が低い)代替品としても使用されていた。そのエアバッグは14人の死亡者を出した後に、危険であるとしてリコールされた[7]。 Cavea-bと呼ばれる硝酸アンモニウムの硝酸溶液は、一般的なモノプロペラントであるヒドラジンの代わりに、よりエネルギーの高い液体燃料として、宇宙船での使用が期待されていた。1960年代には多くの試験が行われたものの、NASAでは採用されなかった。 事故事例→詳細は「硝酸アンモニウムの事故・事件一覧」を参照
場合によっては、硝酸アンモニウムの水溶液も爆発する。1952年12月22日に、愛知県名古屋市の化学工場で水溶液が爆発した[9]。この事故について、日本では特に研究はなされなかったが、その後、アメリカ合衆国で研究された結果、スラリー爆薬が開発された。 タカタのエアバッグの不具合の問題では、エアバッグのガス発生剤に硝酸アンモニウムを使うことが焦点となった。2014年時点で、衝突時にエアバッグを膨らませるためのガス発生剤として硝酸アンモニウムを使っていたのはタカタのみであった。温度の変化によって結晶の形、密度が変わる転移という現象が危惧されるが、タカタは硝酸アンモニウムに他の化学物質を添加し、「相安定化硝酸アンモニウム」とする方法で安定させていると主張した。タカタのエアバッグは、多湿地域でインフレータの暴発が起きた点が問題視された[10]。2015年11月3日に、アメリカ合衆国運輸省は硝酸アンモニウムを使ったガス発生装置の生産、販売の停止を命じ、2018年末までに段階的に取りやめることで合意した[11]。 脚注注釈
出典
関連項目
|
||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia