四ヨウ化ゲルマニウム
識別情報
CAS登録番号 13450-95-8
PubChem
83479
ChemSpider
75317
EC番号
236-613-7
InChI=1S/GeI4/c2-1(3,4)5
Key: CUDGTZJYMWAJFV-UHFFFAOYSA-N
特性
化学式
GeI4
モル質量
580.26 g mol−1
外観
赤色結晶[ 1] [ 2]
密度
4.32 g·cm−3
融点
146 °C (419 K)[ 1]
溶解度
二硫化炭素 、クロロホルム 、ベンゼン 等、非極性溶媒に可溶[ 3]
危険性
GHSピクトグラム
GHSシグナルワード
危険(DANGER)
Hフレーズ
H314
Pフレーズ
P260 , P264 , P264+265 , P280 , P301+330+331 , P302+361+354 , P304+340 , P305+354+338 , P316 , P317 , P321 , P363 , P405 , P501
特記なき場合、データは常温 (25 °C )・常圧 (100 kPa) におけるものである。
四ヨウ化ゲルマニウム (Germanium(IV) iodide)は、化学式GeI4 の化合物である。
ゲルマニウム とヨウ素 の反応[ 2] 二酸化ゲルマニウム と57%ヨウ化水素酸 の反応[ 1]
GeO
四ヨウ化ゲルマニウムは、250℃でテトラアルキルスズ と反応して、R2 SnI2 及びR2 GeI2 (R= Et, Bu, Ph)を生成する[ 4] 硫黄 と高温で反応して、赤色のGeSI2 及び橙色のGe2 S3 I2 を生成する[ 5] イオン液体 ([BMIm]Cl/AlCl3 )中、130℃でノナカルボニル二鉄 と反応して、Ge12 [Fe(CO)3 ]8 I4 を得る[ 6]
12 GeI
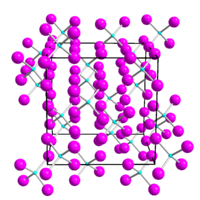
橙色から赤色の結晶 性固体で、水中で加水分解 する。二硫化炭素 及びベンゼン に可溶であるが、四塩化炭素 及びクロロホルム には難溶である[ 3] 融点 を超えると、二ヨウ化ゲルマニウム とヨウ素に分解し始める[ 7] 立方晶系 に結晶化し、空間群 はPa 3 、格子定数 はa = 11.89 Åである。結晶構造 は、四面体 状のGeI4 分子から構成される。
^ a b c A. W. Laubengayer, P. L. Brandt (Feb 1932). “The Preparation of Germanium Tetrabromide and Germanium Tetraiodide” (英語). Journal of the American Chemical Society 54 (2): 621–623. doi :10.1021/ja01341a502 . ISSN 0002-7863 . オリジナル の2021-10-20時点におけるアーカイブ。. https://web.archive.org/web/20211020040925/https://pubs.acs.org/doi/abs/10.1021/ja01341a502 2021年1月12日 閲覧。
^ a b L. M. Dennis, F. E. Hance (Dec 1922). “GERMANIUM. IV. GERMANIUM TETRA-IODIDE1 ” (英語). Journal of the American Chemical Society 44 (12): 2854–2860. doi :10.1021/ja01433a020 . ISSN 0002-7863 . https://pubs.acs.org/doi/abs/10.1021/ja01433a020 2021年1月12日 閲覧。
^ a b Schenk, P.W. (1963). “12. Silicon and Germanium” . In Brauer, Georg. Handbook of preparative inorganic chemistry (Second ed.). Academic Press. p. 719 . doi :10.1016/B978-0-12-395590-6.50020-X . ISBN 978-0-12-395590-6 . https://archive.org/details/handbookpreparat00brau
^ Kocheshkov, K. A.; Fomina, N. V.; Sheverdina, N. I.; Zemlyanskii, N. N.; Chernoplekova, V. A. Reaction of tetraalkyltin with germanium tetrahalides. Izvestiya Akademii Nauk SSSR, Seriya Khimicheskaya , 1973. 3: 711. ISSN 0002-3353 .
^ A.P. Velmuzhov, M.V. Sukhanov, A.D. Plekhovich, A.I. Suchkov, V.S. Shiryaev (Mar 2015). “Thermal decomposition study of GeSI2 and Ge2S3I2 glassy alloys” (英語). Journal of Non-Crystalline Solids 411 : 40–44. Bibcode : 2015JNCS..411...40V . doi :10.1016/j.jnoncrysol.2014.09.018 . https://linkinghub.elsevier.com/retrieve/pii/S0022309314004736 2021年1月12日 閲覧。 ^ Silke Wolf, Wim Klopper, Claus Feldmann (2018). “Ge 12 {Fe(CO) 3 } 8 (μ-I) 4 : a germanium–iron cluster with Ge 4 , Ge 2 and Ge units” (英語). Chemical Communications 54 (10): 1217–1220. doi :10.1039/C7CC08091C . ISSN 1359-7345 . PMID 29336437 . http://xlink.rsc.org/?DOI=C7CC08091C 2021年1月12日 閲覧。 ^ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1995). Lehrbuch der anorganischen Chemie (101., verb. und stark erw. Aufl ed.). Berlin: de Gruyter. ISBN 978-3-11-012641-9