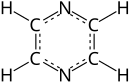
ピラジン
別称
1,4-Diazabenzene, p-Diazine, 1,4-Diazine, Paradiazine, Piazine, UN 1325
識別情報
CAS登録番号 290-37-9
PubChem
9261
ChemSpider
8904
UNII
2JKE371789
EC番号
206-027-6
ChEBI
ChEMBL
CHEMBL15797
InChI=1S/C4H4N2/c1-2-6-4-3-5-1/h1-4H
Key: KYQCOXFCLRTKLS-UHFFFAOYSA-N
InChI=1/C4H4N2/c1-2-6-4-3-5-1/h1-4H
特性
化学式
C4 H4 N2
モル質量
80.09 g/mol
外観
白色結晶
密度
1.031 g/cm3
融点
52 °C , 325 K, 126 °F
沸点
115 °C , 388 K, 239 °F
水 への溶解度
Soluble
酸解離定数 pK a
0.37[ 2]
磁化率
× 10−6 cm3 /mol
危険性
GHSピクトグラム
GHSシグナルワード
危険(DANGER)
Hフレーズ
H228 , H315 , H319 , H335
Pフレーズ
P210 , P261 , P305+351+338
NFPA 704
Rフレーズ
R11 R36/37/38
Sフレーズ
S16 S26 S36
引火点
55 °C (131 °F; 328 K) (c.c.)
特記なき場合、データは常温 (25 °C )・常圧 (100 kPa) におけるものである。
この項目「
ピラジン 」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:
Pyrazine )
修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。
ノートページ や
履歴 も参照してください。
(2023年2月 )
ピラジン (英 : Pyrazine )は分子式 C4 H4 N2 の複素環式化合物 であり、芳香族化合物 の一つ。ベンゼン の1,4位の炭素 が窒素 で置換された対称的な構造(点群 D2h )を持つ。
類縁体 にピリジン 、異性体 にピリダジン 、ピリミジン があり、それらに比べて塩基 性が弱い(参考: ピリジンのpKaは約5.2)。トウモロコシ様もしくは木の実様の甘い刺激臭をもつ、潮解 性のロウ状固体を呈する[ 3]
食品の加熱調理の際に、メイラード反応 (アミノカルボニル反応、端的にはアミノ酸と糖の反応)によるピラジンおよび様々な低級アルキルピラジン (英語版 ) テトラメチルピラジン (リグストラジン)はヒトの顆粒球 においてスーパーオキシドアニオン を捕捉 し、一酸化窒素 の産生を抑えることが報告されている[ 4]
ピラジンの誘導体には香料 ・農薬 など様々な用途がある。
ピラジンおよびその誘導体 を有機合成 するために様々な合成方法が開発されている。
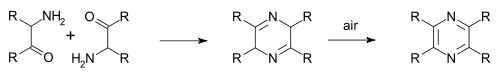
1876年 に報告されたStaedel–Rügheimerピラジン合成反応 は、2-クロロアセトフェノン をアンモニア と反応させてアミノケトンとし、これを縮合 させたのちに酸化 してピラジンを得る反応である[ 5] 1879年 に報告されたGutknechtピラジン合成反応 があり、同じく自己縮合 を利用しているが、α-ケトアミンを合成する方法が異なる[ 6] [ 7]
さらなる亜種としてGastaldi合成 (1921年 )が挙げられる[ 8]
^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 . The Royal Society of Chemistry . pp. 141. doi :10.1039/9781849733069 . ISBN 978-0-85404-182-4 ^ Brown, H.C., et al., in Baude, E.A. and Nachod, F.C., Determination of Organic Structures by Physical Methods , Academic Press, New York, 1955.
^ “Pyrazine | C4H4N2 | ChemSpider ”. www.chemspider.com . 4 January 2022 閲覧。 ^ Zhang, Zhaohui (2003). “Tetramethylpyrazine scavenges superoxide anion and decreases nitric oxide production in human polymorphonuclear leukocytes”. Life Sciences 72 (22): 2465–2472. doi :10.1016/S0024-3205(03)00139-5 . PMID 12650854 . ^ Ueber die Einwirkung von Ammoniak auf Chloracetylbenzol (pp. 563–564) W. Staedel, L. Rügheimer doi :10.1002/cber.187600901174 Berichte der deutschen chemischen Gesellschaft Volume 9, Issue 1, pp. 563–564, 1876^ Mittheilungen Ueber Nitrosoäthylmethylketon H. Gutknecht Berichte der deutschen chemischen Gesellschaft Volume 12, Issue 2 , pp. 2290–2292, 1879 doi :10.1002/cber.187901202284 ^ Heterocyclic chemistry T.L. Gilchrist ISBN 0-582-01421-2 ^ Amines: Synthesis, Properties and Applications Stephen A. Lawrence 2004 Cambridge University Press ISBN 0-521-78284-8
単環
二環
五員環+五員環 五員環+六員環 六員環+六員環 五員環+七員環