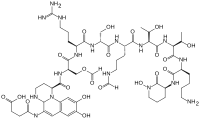
ピオベルジン
識別情報
PubChem
45479427
CC(C1C(=O)NC(C(=O)NCCCCC(C(=O)NC(C(=O)N1)CCCN(C=O)O)NC(=O)C(CCCN(C=O)O)NC(=O)C(CO)NC(=O)C(CCCN=C(N)N)NC(=O)C(CO)NC(=O)C2CCNC3N2C4=CC(=C(C=C4C=C3NC(=O)CCC(C(=O)O)N)O)O)C(C)O)O
Key: QIRRYPHVUMPBDX-UARRTFJPSA-N
特性
化学式
C56 H88 N18 O22
モル質量
1365.41 g mol−1
外観
固体
特記なき場合、データは常温 (25 °C )・常圧 (100 kPa) におけるものである。
ピオベルジン (Pyoverdines、稀にpyoverdins、Pvd)とは、水溶性の黄緑の蛍光性 色素 の一種である化学物質である[ 1] シュードモナス属 菌種によって産生される蛍光性シデロホア の一種であり[ 2] [ 3] 病原性因子 の一つである。産生主である病原菌に向けて、栄養素(鉄など)の供給、産生主の病原性因子(菌体外毒素A やタンパク質分解酵素 PrpL など)の制御[ 4] バイオフィルム の形成の援助[ 5] [ 6] [ 7] [ 8]
ピオベルジンは、薬剤耐性菌 へ抗生物質 を届けるトロイの木馬 分子として利用方法が検証されている[ 9] 銅 などの無機栄養素の補給促進に使われたり[ 10] レポーター分子 として利用されたりしている[ 11] ペプチド 鎖は異なり、シュードモナス種を特定したり特徴付けたりするためのマーカー分子としての可能性もある[ 1]
他のシデロホア 同様、ピオベルジンは微生物によって産生され、環境中へと分泌される。産生と分泌の引き金は細胞中の鉄濃度であり、これが特定の閾値 を下回った時に引き金が引かれる。シデロホアは一般に三価鉄に対して非常に強い結合活性を有し、なおかつ金属との錯体 は水溶性を示す。環境中の鉄分を水に溶かし、細胞に吸収可能にする。土壌中の鉄はほぼ難溶性の三価鉄として存在するため、シデロホアなしに土壌微生物と陸棲植物は生育に十分な量の鉄を摂取することはできない。
生産主の成長促進効果以外にも、ピオベルジンには様々な役割がある。病原性の制御、鉄の利用可能性の抑制による他の競合細菌の生育の阻害、有害な重金属 の隔離によるその毒性の回避などである。
ピオベルジンはペプチド鎖の配列によりタイプ(siderotype)が異なり、これまで100以上のタイプが発見されている[ 12] キノリン の核、菌株間で異なる6-14個のアミノ酸から成るペプチド、および側鎖である。側鎖は通常、クエン酸回路 で合成された4-5個の炭素のα-ケト酸 である。ピオベルジンの黄色の発色と蛍光はその核に由来する。
ジヒドロキシキノリン の核は(1S)-5-アミノ-2,3-ジヒドロ- 8,9-ジヒドロキシ-1H-ピリミド[1,2-a]キノリン-1-酢酸を含む。この部分はあらゆるピオベルジンで変わらない。
この核は、6-14個のアミノ酸 から成るペプチド で修飾されている。このペプチドは核の発色団 に付加されており、非リボソームペプチドの合成過程を通して合成される[ 13] [ 14] N -5-ホルミル-N -5-ヒドロキシオルニチン といった特殊アミノ酸をしばしば含んでいる。修飾ペプチドは部分的に、あるいは全体的に環化している。ヒドロキサム酸 やヒドロキシ酢酸のどちらかまたは両方を介した六座配位結合を行う4つの部位を提供する。この部位は、鉄ーピオベルジン複合体が細胞中へ輸送する鉄ーピオベルジン複合体受容体(FpvA)との相互作用において重要である。シュードモナス属 菌株が産生するペプチドは全て同じである。
ピオベルジンにはそれぞれ異なるケト酸側鎖が結合している。現在までピオベルジンとしてコハク酸 /スクシンイミド 、グルタミン酸 、グルタル酸 、リンゴ酸 /リンゴ酸アミド、およびα-ケトグルタル酸 が発見されている。しかし、ケト酸側鎖の機能や重要性についてはっきりしていることは少ない[ 15]
シュードモナス属の蛍光性菌株におけるピオベルジンの修飾ペプチドの骨格構造。一つの大文字と2つの小文字による3文字はアミノ酸の暗号。ただし、Q = 発色団、DXxx=D-アミノ酸、aThr=アロトレオニン、c=環状構造、cOHOrn=環状ヒドロキシオルニチン、Dab=ジアミノ酪酸、Ac=アセチル、Fo=ホルミル、OH=ヒドロキシ[ 16]
種
菌株
ピオベルジンの修飾ペプチドの構造
P. aeruginosa
ATCC15692 (PAO1)
Q-DSer-Arg-DSer-FoOHOrn-c(Lys-FoOHOrn-Thr-Thr)
P. aeruginosa
ATCC27853
Q-DSer-FoOHDOrn-Orn-Gly-aDThr-Ser-cOHOrn
P. aeruginosa
Pa6
Q-DSer-Dab-FoOHOrn-Gln-DGln-FoOHDOrn-Gly
P. chlororaphis
ATCC9446
Q-DSer-Lys-Gly-FoOHOrn-c(Lys-FoOHDOrn-Ser)
P. fluorescens bv.I
ATCC13525
Q-DSer-Lys-Gly-FoOHOrn-c(Lys-FoOHDOrn-Ser)
P. fluorescens bv.I
9AW
Q-DSer-Lys-OHHis-aDThr-Ser-cOHOrn
P. fluorescens bv.III
ATCC17400
Q-DAla-DLys-Gly-Gly-OHAsp-DGln/Dab-Ser-DAla-cOHOrn
P. fluorescens bv.V
51W
Q-DAla-DLys-Gly-Gly-OHDAsp-DGln-DSer-Ala-Gly-aDThr-cOHOrn
P. fluorescens bv.V
1W
Q-DSer-Lys-Gly-FoOHOrn-c(Lys-FoOHDOrn-Ser)
P. fluorescens bv.V
10CW
Q-DSer-Lys-Gly-FoOHOrn-c(Lys-FoOHDOrn-Ser)
P. fluorescens bv.VI
PL7
Q-DSer-AcOHDOrn-Ala-Gly-aDThr-Ala-cOHOrn
P. fluorescens bv.VI
PL8
Q-DLys-AcOHDOrn-Ala-Gly-aDThr-Ser-cOHOrn
P. fluorescens
1.3
Q-DAla-DLys-Gly-Gly-OHAsp-DGln/Dab-Gly-Ser-cOHOrn
P. fluorescens
18.1
Q-DSer-Lys-Gly-FoOHOrn-Ser-DSer-Gly-c(Lys-FoOHDOrn-Ser)
P. fluorescens
CCM 2798
Q-Ser-Dab-Gly-Ser-OHDAsp-Ala-Gly-DAla-Gly-cOHOrn
P. fluorescens
CFBP 2392
Q-DLys-AcOHDOrn-Gly-aDThr-Thr-Gln-Gly-DSer-cOHOrn
P. fluorescens
CHA0
Q-Asp-FoOHDOrn-Lys-c(Thr-Ala-Ala-FoOHDOrn-Lys)
P. putida bv. B
9BW
Q-DSer-Lys-OHHis-aDThr-Ser-cOHOrn
P. putida
CFBP 2461
Q-Asp-Lys-OHDAsp-Ser-aDThr-Ala-Thr-DLys-cOHOrn
P. tolaasii
NCPPB 2192
Q-DSer-Lys-Ser-DSer-Thr-Ser-AcOHOrn-Thr-DSer-cOHDOrn
蛍光性を有し、特徴的な励起および発光スペクトルを示す。生理的リガンドである鉄と結合すると高速かつ強力に消光 する。励起およびモル吸光率は中程度のpH依存性を示し、一方、蛍光はpHに依存しない。分光吸収は蛍光とは異なり、鉄との結合でほとんど消光しない。このため、分子緩和の機構は電磁放射ではなく振動だと考えられている。
ピオベルジンはその6個の酸素原子(ジヒドロキシキノリンに2個、骨格中の2つのアミノ酸にそれぞれ2個)により鉄と六座配位する。この結果、非常に窮屈な八面体形分子構造 が作られ、鉄との結合を邪魔する水や他の分子の侵入は防がれる。典型的には、ピオベルジンに結合された第二鉄は、第一鉄への還元により放出される。第二鉄と異なり、第一鉄へのピオベルジンの結合活性は109 M-1 と非常に低いためである。還元後、第一鉄は他の輸送体に引き渡され、鉄を失ったピオベルジンは引き続き細胞内外へ輸送されて利用される。
シュードモナス属 Pseudomonas のゲノム において、ピオベルジンの生合成や分泌、吸収、制御を支配する遺伝子は一つまたは三つの遺伝子座 に置かれている[ 17] pvd は、Pseudomonas aeruginosa [ 18]
ピオベルジンの生合成と取り込みは二つの細胞質外シグマ因子 (extracytoplasmic sigma factor (ECF-σ))のPvdSとFpvI、および対シグマ因子FpvRによって制御されている[ 18] リプレッサー FpvIによる核様体 からのPvdSの隔離により制御が行われる。
ピオベルジンの生合成において不明な点は多い。理由は不明だが、ピオベルジンの生合成は抗がん剤のフルオロウラシル によって[ 19] [ 20] [ 21] [ 22]
核の生合成経路ははっきりしていない。pvcCとpvcDの欠損がピオベルジンの生合成を停止させたことから、もともとpvcABCD オペロン によって生合成は行われていると考えられていた[ 23] pvcABCD が関与しているのは別の物質(paerucumarin)の生合成であり、ピオベルジンの生合成には関与していないとする研究結果もある[ 24] ホモログ を欠いている。
現在、他に考えられている生合成経路は、pvdL がグルタミン酸 、2,4,5-トリヒドロキシフェニルアラニン 、およびL-2,4-ジアミノ酪酸 を組み合わせるというものである[ 25]
ピオベルジンのペプチド 鎖の生合成に関わる遺伝子にはpvdHやpvdA、pvdF などが知られている。これらの遺伝子はペプチド鎖の前駆体や、ピオベルジンの各部分に必要なアミノ酸の合成に関与する[ 26] pvdI やpvdJ はペプチド鎖同士の組み合わさりに直接関わる。pvdD はペプチド鎖合成を停止させて前駆体を細胞質 へと放出させる。
ペプチド鎖の生合成は非リボソームペプチド 合成酵素によって、修飾は細胞質 と恐らくペリプラズム で合成酵素の随伴酵素によって行われる[ 17]
ケト酸は、D-チロシン、L-2,4-ジアミノ酪酸、およびL-グルタミン酸から核の発色団が合成された際、L-グルタミン酸として核に取り込まれる。この後に何らかの過程を経て、このL-グルタミン酸の一部は他のケト酸(α-ケトグルタル酸、コハク酸/スクシンイミド)に変換される。
ピオベルジンの細胞外輸送は、Pvdタンパク質の多くがペリプラズム とその外膜(PvdNやPvdO、PvdP、PvdQなど)に移動した後に起こると考えられている。この移動は、ABC輸送体 の相同体であるPvdEによって行われると予想されている。未熟ピオベルジンの成熟化はペリプラズムで起こる。完全に成熟するとピオベルジンはPvdRT-OpmQ排出ポンプで輸送される。ただし、細胞外への輸送は未熟ピオベルジンがどの程度まで成熟すれば行われるかは不明である。
ピオベルジンの全合成法として、P. aeruginosa [ 27] ペプチド固相合成法 が報告されている。ペプチド固相合成法では収率は48%以上と高い。また、抗菌成分を付加したピオベルジンの創出を可能にすると期待されている。
ピオベルジンは、カエノラブディティス・エレガンス (Caenorhabditis elegans )やハツカネズミ など多くの生物の火傷個体や肺炎個体などにおいて発病に要求される[ 28] 緑膿菌 Pseudomonas aeruginosa は他の生物への感染にピオベルジンを必要とする[ 29]
ピオベルジンはいくつかの発病要素に寄与する。それには、ピオベルジン自身、翻訳を停止させる外毒素A、およびタンパク質分解酵素のPrpLの生合成の制御も含む。必須ではないが、病原性に重要なバイオフィルムの形成と発展を助ける。
ヒトを含むある種の生物はシデロホア産生細菌の感染を防ぐために、neutrophil-gelatinase-associated lipocalin (NGAL)を産生する。NGALはシデロホアと結合して除去する。しかし、NGALはエンテロバクチンと結合するが、ピオベルジンには結合しない。こうして、ピオベルジンはNGALによる防御機構を回避する[ 30]
ピオベルジン自身も様々な形態の毒性を示す。シュードモナス・フルオレッセンス (Pseudomonas fluorescens )由来のピオベルジンは哺乳動物の白血球に対して毒性を持ち、この毒性は少なくとも部分的に活性酸素種に依存する[ 31] C. elegans C. elegans の細胞に侵入し、ミトコンドリア動態を不安定にし、低酸素症 を誘発させる。ピオベルジンによる低酸素症に伴う応答は、HIF-1 タンパク質による症状と一致している。このことから、アデノシン三リン酸 の合成のための生体分子の不足が作用機序の一部であると考えられている。
1850s 創傷被覆材から青緑色の発色をSedillotが指摘。
1860 Fordosにより創傷被覆材からピオベルジン(当時は未命名)が抽出される。
1862 Luckeの顕微鏡観察によりピオベルジンと細菌との関連が指摘される。
1882 Carle Gessardは現在のPseudomonas aeruginosa Bacillus aeruginosa )を初めて純培養し、『包帯の青と緑の着色について』(原題:On the Blue and Green Coloration of Bandages)で報告した。
1889 Bouchardは炭疽菌Bacillus anthracis P. aeruginosa
1889 Bouchardは紫外線 下でのピオベルジンの蛍光をは発見した。
1948, 1952 ピオベルジンおよび鉄の濃度に相互作用があることが初めて観察された。
1978 Meyerらは鉄獲得におけるピオベルジンの役割を初めて実証した。
1980s–1990s 構造と制御機構が初めて考案された。
1999 鉄との結合による消光 が初めて観察された。
^ a b Jean-Marie Meyer (Sep 2000). “Pyoverdines: pigments, siderophores and potential taxonomic markers of fluorescent Pseudomonas species” . Archives of Microbiology 174 (3). doi :10.1007/s002030000188 . PMID 11041343 . https://link.springer.com/article/10.1007/s002030000188 .
^ S. Wendenbaum; P. Demange; A. Dell; J. M. Meyer; M. A. Abdallah (1983). “The structure of pyoverdine Pa, the siderophore of Pseudomonas aeruginosa”. Tetrahedron Letters 24 (44): 4877–4880. doi :10.1016/S0040-4039(00)94031-0 . ^ Menhart, N.; Thariath, A.; Viswanatha, T. (1991). “Characterization of the pyoverdines of Azotobacter vinelandii ATCC 12837 with regard to heterogeneity”. Biology of Metals 4 (4): 223–32. doi :10.1007/bf01141185 . ^ Lamont, Iain L.; Beare, Paul A.; Ochsner, Urs; Vasil, Adriana I.; Vasil, Michael L. (2002-05-14). “Siderophore-mediated signaling regulates virulence factor production in Pseudomonasaeruginosa” . Proceedings of the National Academy of Sciences of the United States of America 99 (10): 7072–7077. doi :10.1073/pnas.092016999 . ISSN 0027-8424 . PMC 124530 . PMID 11997446 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC124530/ . ^ Banin, Ehud; Vasil, Michael L.; Greenberg, E. Peter (2005-08-02). “Iron and Pseudomonas aeruginosa biofilm formation” . Proceedings of the National Academy of Sciences of the United States of America 102 (31): 11076–11081. doi :10.1073/pnas.0504266102 . ISSN 0027-8424 . PMC 1182440 . PMID 16043697 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1182440/ . ^ Kirienko, Natalia V.; Kirienko, Daniel R.; Larkins-Ford, Jonah; Wählby, Carolina; Ruvkun, Gary; Ausubel, Frederick M. (2013-04-17). “Pseudomonas aeruginosa disrupts Caenorhabditis elegans iron homeostasis, causing a hypoxic response and death” . Cell Host & Microbe 13 (4): 406–416. doi :10.1016/j.chom.2013.03.003 . ISSN 1934-6069 . PMC 3641844 . PMID 23601103 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3641844/ . ^ Kirienko, Natalia V.; Ausubel, Frederick M.; Ruvkun, Gary (2015-02-10). “Mitophagy confers resistance to siderophore-mediated killing by Pseudomonas aeruginosa” . Proceedings of the National Academy of Sciences of the United States of America 112 (6): 1821–1826. doi :10.1073/pnas.1424954112 . ISSN 1091-6490 . PMC 4330731 . PMID 25624506 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4330731/ . ^ Minandri, Fabrizia; Imperi, Francesco; Frangipani, Emanuela; Bonchi, Carlo; Visaggio, Daniela; Facchini, Marcella; Pasquali, Paolo; Bragonzi, Alessandra et al. (2016-08-01). “Role of Iron Uptake Systems in Pseudomonas aeruginosa Virulence and Airway Infection” . Infection and Immunity 84 (8): 2324–2335. doi :10.1128/IAI.00098-16 . ISSN 1098-5522 . PMC 4962624 . PMID 27271740 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4962624/ . ^ Agnieszka Górska, Anna Sloderbach, Michał Piotr Marszałł (Sep 2014). “Siderophore–drug complexes: potential medicinal applications of the ‘Trojan horse’ strategy” . Trends in Pharmacological Sciences 35 (9): 442-449. doi :10.1016/j.tips.2014.06.007 . http://www.cell.com/trends/pharmacological-sciences/fulltext/S0165-6147(14)00110-2 . ^ J. Y. Cornu, M. Elhabiri, C. Ferret, V. A. Geoffroy, K. Jezequel, Y. Leva, M. Lollier, I. J. Schalk, T. Lebeau (May 2014). “Contrasting effects of pyoverdine on the phytoextraction of Cu and Cd in a calcareous soil” . Chemosphere 103 : 212-219. doi :10.1016/j.chemosphere.2013.11.070 . http://www.sciencedirect.com/science/article/pii/S0045653513016603 . ^ Yoder, Michael F.; Kisaalita, William S. (2011-01-01). “Iron specificity of a biosensor based on fluorescent pyoverdin immobilized in sol-gel glass” . Journal of Biological Engineering 5 : 4. doi :10.1186/1754-1611-5-4 . ISSN 1754-1611 . https://doi.org/10.1186/1754-1611-5-4 . ^ M Jean-Marie, G Valérie (2005). “Analyzing Pseudomonas biodiversity: An easy challenge thanks to siderophore typing”. In T. Satyanarayana、B. N. Johr. Microbial Diversity: Current Perspectives and Potential Applications . I. K. International Pvt Ltd. pp. 311-313 ^ Hohlneicher, U.; Schäfer, M.; Fuchs, R.; Budzikiewicz, H. (2016-10-11). “Ferribactins as the biosynthetic precursors of the Pseudomonas siderophores pyoverdins”. Zeitschrift für Naturforschung C 56 (3–4): 308–310. ISSN 0939-5075 . PMID 11371026 . ^ Visca, Paolo; Imperi, Francesco; Lamont, Iain L. (2007-01-01). “Pyoverdine siderophores: from biogenesis to biosignificance”. Trends in Microbiology 15 (1): 22–30. doi :10.1016/j.tim.2006.11.004 . ISSN 0966-842X . PMID 17118662 . ^ Budzikiewicz, H (1997). “Siderophores of Fluorescent Pseudomonads”. Zeitschrift für Naturforschung C 52 (11–12): 713–720. ^ Meyer, J. M. (2000). “Pyoverdines: Pigments, siderophores and potential taxonomic markers of fluorescent Pseudomonas species”. Archives of Microbiology 174 (3): 135–142. doi :10.1007/s002030000188 . PMID 11041343 . ^ a b Ravel J, Cornelis P (May 2003). “Genomics of pyoverdine-mediated iron uptake in pseudomonads” . Trends in Microbiology 11 (5): 195-200. doi :10.1016/S0966-842X(03)00076-3 . PMID 12781517 . http://www.sciencedirect.com/science/article/pii/S0966842X03000763 .
^ a b Lamont, I. L. (2003). “Identification and characterization of novel pyoverdine synthesis genes in Pseudomonas aeruginosa”. Microbiology 149 (4): 833–842. doi :10.1099/mic.0.26085-0 .
^ Imperi, Francesco; Massai, Francesco; Facchini, Marcella; Frangipani, Emanuela; Visaggio, Daniela; Leoni, Livia; Bragonzi, Alessandra; Visca, Paolo (2013-04-30). “Repurposing the antimycotic drug flucytosine for suppression of Pseudomonas aeruginosa pathogenicity” . Proceedings of the National Academy of Sciences of the United States of America 110 (18): 7458–7463. doi :10.1073/pnas.1222706110 . ISSN 1091-6490 . PMC 3645532 . PMID 23569238 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3645532/ . ^ Kirienko, Daniel R. (2016-08-01). “A High-Content, Phenotypic Screen Identifies Fluorouridine as an Inhibitor of Pyoverdine Biosynthesis and Pseudomonas aeruginosa Virulence” . mSphere 1 (4): e00217-16. doi :10.1128/mSphere.00217-16 . ISSN 2379-5042 . PMC 4999921 . PMID 27579370 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4999921/ . ^ Cornelis, P (1989). “Evidence for different pyoverdine-mediated iron uptake systems among Pseudomonas aeruginosa strains”. Infect Immun 57 (11): 3491–3497. ^ Hohnadel, Dany (1986-09-01). “Mapping of mutations affecting pyoverdine production in Pseudomonas aeruginosa” (英語). FEMS Microbiology Letters 36 (2–3): 195–199. doi :10.1111/j.1574-6968.1986.tb01695.x . ISSN 0378-1097 . http://femsle.oxfordjournals.org/content/36/2-3/195-1 . ^ Stintzi, A. (1999-07-01). “The pvc gene cluster of Pseudomonas aeruginosa: role in synthesis of the pyoverdine chromophore and regulation by PtxR and PvdS” . Journal of Bacteriology 181 (13): 4118–4124. ISSN 0021-9193 . PMC 93907 . PMID 10383985 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC93907/ . ^ Clarke-Pearson, Michael F.; Brady, Sean F. (2008-10-01). “Paerucumarin, a new metabolite produced by the pvc gene cluster from Pseudomonas aeruginosa” . Journal of Bacteriology 190 (20): 6927–6930. doi :10.1128/JB.00801-08 . ISSN 1098-5530 . PMC 2566218 . PMID 18689486 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2566218/ . ^ Stintzi, A (1996). “Novel pyoverdine biosynthesis gene(s) of Pseudomonas aeruginosa PAO”. Microbiology 142 (5): 1181–1190. doi :10.1099/13500872-142-5-1181 . PMID 8704959 . ^ Cézard, C.; Farvacques, N.; Sonnet, P. (2015-01-01). “Chemistry and biology of pyoverdines, Pseudomonas primary siderophores”. Current Medicinal Chemistry 22 (2): 165–186. doi :10.2174/0929867321666141011194624 . ISSN 1875-533X . PMID 25312210 . ^ Mashiach, Roi (2013-04-05). “Total synthesis of pyoverdin D”. Organic Letters 15 (7): 1702–1705. doi :10.1021/ol400490s . ISSN 1523-7052 . PMID 23530778 . ^ Takase, H. (2000-04-01). “Impact of siderophore production on Pseudomonas aeruginosa infections in immunosuppressed mice” . Infection and Immunity 68 (4): 1834–1839. doi :10.1128/iai.68.4.1834-1839.2000 . ISSN 0019-9567 . PMC 97355 . PMID 10722571 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC97355/ . ^ Paolo Visca, F. Imperi, Iain L. Lamont (Jun 2007). “Pyoverdine siderophores: from biogenesis to biosignificance” . Trends Microbiology 15 (1): 22-30. doi :10.1016/j.tim.2006.11.004 . PMID 17118662 . https://doi.org/10.1016/j.tim.2006.11.004 . ^ Mary E. Peek, Abhinav Bhatnagar, Nael A. McCarty, and Susu M. Zughaier (2012). “Pyoverdine, the Major Siderophore in Pseudomonas aeruginosa , Evades NGAL Recognition” . Interdisciplinary Perspectives on Infectious Diseases 2012 : 10. doi :10.1155/2012/843509 . PMC 3438788 . PMID 22973307 . https://www.ncbi.nlm.nih.gov/pubmed/22973307 . ^ Becerra, C. (2001-07-13). “Leukotoxicity of Pyoverdin, Production of Reactive Oxygen Species, and Effect of UV Radiation” . Biochemical and Biophysical Research Communications 285 (2): 414–418. doi :10.1006/bbrc.2001.5188 . PMID 11444858 . http://www.sciencedirect.com/science/article/pii/S0006291X01951885 .