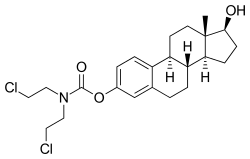
エストラムスチンリン酸エステル
IUPAC命名法 による物質名
[(8R ,9S ,13S ,14S ,17S )-13-methyl-17-phosphonooxy-6,7,8,9,11,12,14,15,16,17-decahydrocyclopenta[a ]phenanthren-3-yl] N ,N -bis (2-chloroethyl)carbamate 臨床データ 販売名
Emcyt, Estracyt Drugs.com
monograph MedlinePlus
a608046 ライセンス
US FDA :リンク 胎児危険度分類
法的規制
薬物動態 データ生物学的利用能 44–75% (as estramustine and estromustine)[ 1] 血漿タンパク結合 • Estradiol: 98%[ 2] [ 2] 代謝 Liver , intestines [ 3] [ 1] [ 4] 代謝物質 • Estramustine [ 3] [ 1] Estromustine [ 3] [ 1] Estradiol [ 3] [ 1] Estrone [ 3] [ 1] Phosphoric acid [ 3] [ 1] Normustine [ 5] 半減期 • EMP: 1.27 hr[ 6] • Estromustine: 10–14 hr[ 1] [ 1] 排泄 Bile , feces (2.9–4.8%)[ 1] [ 4] データベースID CAS番号
4891-15-0 sodium )meglumine ) ATCコード
L01XX11 (WHO PubChem
CID: 259329 IUPHAR/BPS (英語版 )
9076 DrugBank
DB01196 ChemSpider
227633 UNII
MUZ9585Y7B KEGG
D02398+D06397 ChEBI
CHEBI:68643 ChEMBL
CHEMBL1756 別名
EMP; Leo 299; NSC-89199; Ro 21-8837/001; Estradiol normustine phosphate; Estradiol 3-normustine 17β-phosphate; Estradiol 3-(bis(2-chloroethyl)carbamate) 17β-(dihydrogen phosphate) 化学的データ 化学式 C 23 H 32 Cl 2 N O 6 P 分子量 520.38 g·mol−1
C[C@]12CC[C@H]3[C@H]([C@@H]1CC[C@@H]2OP(=O)(O)O)CCC4=C3C=CC(=C4)OC(=O)N(CCCl)CCCl
InChI=1S/C23H32Cl2NO6P/c1-23-9-8-18-17-5-3-16(31-22(27)26(12-10-24)13-11-25)14-15(17)2-4-19(18)20(23)6-7-21(23)32-33(28,29)30/h3,5,14,18-21H,2,4,6-13H2,1H3,(H2,28,29,30)/t18-,19-,20+,21+,23+/m1/s1 Key:ADFOJJHRTBFFOF-RBRWEJTLSA-N テンプレートを表示
エストラムスチン リン酸 エステル (Estramustine phosphate;EMP)は、男性の前立腺癌 の治療に用いられるエストロゲン 作用とアルキル化 作用の2つの作用を持つ医薬品である[ 7] [ 5] [ 8] [ 9] [ 10] [ 3] [ 1] [ 11] [ 6] [ 12] [ 13] [ 1] [ 3] [ 7] [ 8] [ 3] [ 1] [ 6] [ 12] ナトリウム 塩水和物 の経口カプセル剤が承認されている[ 14]
EMPの副作用には、悪心 、嘔吐 、女性化 、脱男性化 、性機能障害 、血栓 、心血管系合併症 などがある[ 3] [ 9] [ 15] 抗ゴナドトロピン作用 および機能的抗アンドロゲン作用 を有する[ 5] [ 1] [ 3] [ 13]
EMPは1970年代初頭に医療用として導入された[ 3] 米国 、カナダ 、英国 、欧州諸国 、日本 など、世界各国で販売されている[ 16] [ 17]
米国では「転移性および進行性前立腺癌の姑息的治療 」に[ 4] [ 18] [ 6] [ 1] [ 10] [ 3] 奏効率 は、従来の高用量エストロゲン療法 (英語版 ) [ 19]
EMPは比較的重い副作用と毒性があるため、特に今日の欧米諸国では前立腺癌の治療にはほとんど使用されていない[ 5] リュープロレリン のようなゴナドトロピン放出ホルモン 調節薬(GnRH modulators)の副作用が乏しいことから、EMPはほとんど見放されていた[ 3] [ 3]
EMPは、140~1,400mg/日の用量で経口投与される[ 20] 忍容性 が改善され、毒性が減少することが判明している[ 5] [ 1]
EMPおよびポリリン酸エストラジオール (英語版 ) エチニルエストラジオール などのエストロゲンは、GnRH調節薬 (英語版 ) 酢酸アビラテロン 、エンザルタミド などの新しい治療法よりも遥かにコストが低い[ 5] [ 21] [ 22] 骨粗鬆症 や骨折 、火照り、認知 、代謝 状態などの点で、他のアンドロゲン除去療法 (英語版 ) [ 5] [ 22]
EMPは、前立腺癌の男性におけるGnRH作動薬療法開始時のテストステロン の一過性上昇を防ぐためにも使用される[ 23]
次の患者には禁忌である[ 14]
海外では体液貯留 にも禁忌とされる[ 18]
重大な副作用として[ 14]
呼吸困難を伴う顔面、舌、声門、喉頭の腫脹 が知られている。
EMPの副作用 は、全体的に比較的重いと言われている[ 3] 嘔気 、嘔吐 、下痢 などの消化器系 の副作用で、男性の40%に嘔気・嘔吐が見られると報告されている[ 9] [ 1] 予防的 な制吐薬 投与で管理できる[ 9] 治療の中止 (英語版 ) [ 1] 女性化乳房 (男性の乳房の発達)はEMP治療を受けた男性の83%に見られると報告されており、勃起不全 の発生率は女性化乳房のリスクと同等かやや低い可能性があるとされている[ 3] 女性化 、女性型脂肪分布 (英語版 ) 脱男性化 およびインポテンス は、高用量エストロゲン療法 (英語版 ) [ 15] [ 24] 性行為 の減少が報告されている[ 1] エストロゲン 濃度と低いテストステロン 濃度に起因している[ 1] [ 3] 乳房 への予防的照射 は、エストロゲンによる女性化乳房の発生率と重症度を減少させることができる[ 15]
EMPの重篤な副作用は、肺塞栓症、深部静脈血栓症 、脳卒中 、血栓性静脈炎、冠動脈疾患 (虚血性心疾患;心筋梗塞など)、体液貯留を伴う鬱血性心不全 などの血栓塞栓および心血管系合併症 である[ 9] [ 1] ジエチルスチルベストロール と同様に心血管毒性を生じるが、低用量での比較では程度が低い(例えば、EMP 280mg/日 経口投与 vs. ジエチルスチルベストロール 1mg/日 経口投与)[ 3] [ 25] ドセタキセル との併用は同様に血栓塞栓症のリスクを悪化させる可能性がある[ 9] 臨床試験 のメタアナリシス では、EMPを使用した場合の血栓塞栓症の全リスクは4~7%であり、EMPを使用しない化学療法レジメン の0.4%に比べ、相対的に高いことが判明している[ 9] 毒性 によるEMP投与中止の主な原因となっている[ 26] アスピリン 、ワルファリン 、未分画ヘパリン 、低分子量ヘパリン 、ビタミンK拮抗薬 (英語版 ) ジエチルスチルベストロール やエチニルエストラジオール などの他のエストロゲンによる血栓塞栓症のリスクの低減に有用であろう[ 9] [ 27] [ 5]
肝機能検査異常はEMPでよく見られるが、この薬で重度の肝機能障害 が発生することはまれである[ 1] 中枢神経系 の副作用はほとんど見られないが、非常に高用量のEMP(20~140mg/kg/日)を3~6カ月間投与したサルでは、脳室 拡大と神経細胞 の色素沈着 が報告されている[ 1] [ 1] 婦人科 領域出血 が数例観察されている[ 1] 骨髄抑制 などの重大な血液毒性や胃腸毒性 、他の顕著な毒性を伴うことはほとんどないかまったくない、と記述されている[ 6] [ 1] [ 28] 白血球減少 および好中球減少 を引き起こすことが多い他の多くの静注用薬剤とは対照的に、EMPは副作用として実際に白血球増多 を引き起こす[ 29] [ 30]
EMPを280mg/日、150日間経口投与した小規模な低用量試験では、胃腸の刺激性 が男性の15%に見られるだけで、忍容性は著しく改善され、重篤な心血管毒性や深部静脈血栓症の発生は見られなかった[ 3] [ 5] 肝酵素上昇 (英語版 ) [ 3] [ 5]
EMPは、アミトリプチン やイミプラミン などの三環系抗うつ薬 の有効性と毒性を高めることが報告されている[ 18] 牛乳 などの乳製品 や各種栄養補助食品 、制酸薬 などのカルシウム 、アルミニウム 、マグネシウム を含む製品をEMPと同時に摂取すると、EMPとこれらの金属の間に不溶性の錯体 やリン酸塩 が形成され、EMPの吸収、ひいては経口生物学的利用能 が著しく損なわれる可能性がある[ 3] [ 1] [ 18] ACE阻害薬 を同時に服用している場合、血管浮腫 のリスクが増加する可能性がある[ 18]
リン酸が外れたエストラムスチン エストロムスチンの構造式ケト基 に変化している。 エストラジオール はエストロゲン作用を示す代謝産物である。EMPは、エストラジオール ノルムスチンリン酸エステルとも呼ばれ、エストロゲン エステルかつナイトロジェンマスタード エステルである[ 1] [ 3] [ 13] エストラジオール に、ナイトロジェンマスタードであるノルムスチン (英語版 ) [ 1] [ 3] [ 13] 薬力学 的には、エストラムスチン、エストロムスチンおよびエストラジオールのプロドラッグである[ 1] [ 3] エストロゲン受容体 の作動薬 である[ 1] [ 2] 親和性 しか有していない[ 1] 分子量 が約91%大きい[ 31] [ 16] 天然 かつ生物学的に同一な形態のエストロゲン[ 13] [ 1] [ 3]
EMPは、二重の作用機序 で作用する。1) 多くの作用を介した直接的な細胞増殖抑制活性、2) エストロゲン受容体を介した抗ゴナドトロピン作用 (英語版 ) 抗アンドロゲン作用 (英語版 ) 高用量エストロゲン療法 (英語版 ) [ 1] [ 3] [ 13] アンドロゲン 産生を強く抑制してテストステロン などのアンドロゲン の循環血中濃度を低下させ、性ホルモン結合グロブリン 血中濃度を大幅に上昇させて循環血中の遊離アンドロゲンの割合を大きく減少させる効果に加え、前立腺細胞における直接的抗アンドロゲン作用も寄与している[ 28] [ 1] [ 3] [ 5] [ 32] [ 33] [ 34] 遊離アンドロゲン指数 (英語版 ) 除睾術 に比べ、平均4.6倍低いことが判明している[ 33] アンドロゲン遮断 (英語版 ) [ 34] アンドロゲン受容体 の弱い阻害薬 (EC50 = 0.5~3.1 μM)として働くことが知られているが、その臨床的意義は判っていない[ 35] [ 32] [ 3] [ 1]
EMP治療中は、極めて高濃度のエストラジオールおよびエストロンが発生する[ 3] [ 5] 代謝物 は、その最も一般的な副作用と心血管系毒性 の原因となっている[ 1] [ 6] [ 28] ジエチルスチルベストロール およびエチニルエストラジオール と、乳房圧痛 、女性化乳房 、心血管系毒性、肝臓タンパク質合成の変化、テストステロン抑制などのエストロゲン作用の割合および程度は本質的に同じであることが示された[ 7] [ 5] [ 28] [ 34] [ 36] [ 36] [ 37]
EMPの細胞増殖抑制作用の作用機序は複雑であり、部分的にしか解明されていない[ 1] 細胞周期 の有糸分裂期 に関与する機構を阻害すると考えられている[ 1] [ 5] 微小管関連タンパク質 (英語版 ) チューブリン に結合し、微小管 の脱重合(エストラムスチンのKd = 10~20 μM)を生じ、その結果、細胞分裂をG2 /M期 (特にM期)で停止させる[ 1] [ 5] [ 38] 抗悪性腫瘍薬 (アルキル化剤 )であると考えられていた[ 3] [ 10] [ 6] [ 13] [ 1] [ 3] [ 39] [ 1] アポトーシス の誘導、DNA合成 の妨害、核基質 の相互作用、細胞膜 の変化、活性酸素種 (酸素フリーラジカル)の誘導、およびおそらくはさらなるメカニズムなど、他の細胞障害性作用をももたらすことが判明している[ 1] [ 5] 放射線増感作用 を示し、放射線治療 に対する感受性も向上させることが判っている[ 1]
EMPの細胞障害性代謝産物は、前立腺癌 細胞などにおいて選択的 (英語版 ) 組織 内に蓄積される[ 6] [ 1] [ 5] 神経膠腫 、悪性黒色腫 、乳癌 細胞で検出されたプロスタチン または前立腺分泌タンパク質(PSP)としても知られる特異的なエストラムスチン結合タンパク質(EMBP)(エストラムスチンに対するKd =10~35 nM)の存在によるものではないかと考えられている[ 1] [ 5] [ 40] [ 6] [ 5] [ 1]
EMPは当初、エストロゲンとノルムスチンの二重エステルプロドラッグとして開発された。エストロゲン受容体への親和性により、エストロゲン標的組織、即ちエストロゲン受容体陽性の腫瘍細胞に選択的に蓄積されるアルキル化抗悪性腫瘍薬となり[ 5] [ 13] [ 2] 有効性 と忍容性 が改善されると考えられた[ 5] 開裂 は非常に限られており、開裂速度も遅く、EMPにはアルキル化活性がないことが判明した[ 5] [ 1] [ 3] [ 28] [ 1] [ 3]
エストラジオールが極めて高く、妊娠 に近い状態にあることが、EMP治療を受けた人に見られる白血球増多 の原因である可能性がある[ 29] [ 30] 骨髄抑制 、白血球減少 および好中球減少 を引き起こす他のほとんどの細胞毒性薬剤とは対照的である。
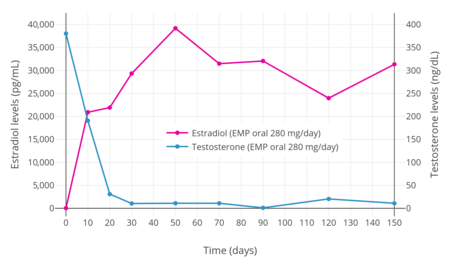
EMPを280mg/日 投与すると、男性のテストステロン値を20日以内に去勢 域(30ng/dLまで)に、30日以内に低去勢域(10ng/dLまで)に抑制することが確認されている[ 3] [ 3]
前立腺癌男性におけるEMP 280mg/日 経口投与時のエストラジオールおよびテストステロン値(n = 11)[ 3]
男性における EMP 560mg/日 継続投与時の
代謝物
血漿中濃度
比率
エストラムスチン
20–23ng/mL
1:9.6–9.8
エストロムスチン
191–267ng/mL
エストラジオール
4.9–9ng/mL
1:9.4–11.8
エストロン
71–85ng/mL
出典 [ 28]
EMP 560〜840mg/日 継続投与時のEMP代謝物の
代謝物
濃度比
エストラムスチン
6.3±2.9
エストロムスチン
1.1±0.4
エストラジオール
1.7±1.1
エストロン
1.1±0.5
出典[ 14]
EMPは経口投与 されると、消化器 内の最初の通過点 でホスファターゼ により迅速かつ完全に脱リン酸化 され、エストラムスチンになる[ 1] [ 5] [ 6] [ 41] 17β-ヒドロキシステロイドデヒドロゲナーゼ (英語版 ) 酸化 され、エストロムスチンに変換される[ 6] [ 1] [ 12] [ 42] 循環血中 に到達し、EMPの主要代謝物 はエストロムスチンである[ 1] [ 12] エストラジオール とエストロン にさらにゆっくりと代謝される[ 1] [ 5] [ 28] カルバミダーゼ によって触媒 されると考えられているが、その酵素をコードする遺伝子 は明らかにされていない[ 1] [ 43] [ 44] [ 39] [ 45] カルボン酸 基の開裂によるノルムスチンからのナイトロジェンマスタード ガスの放出は証明されておらず、発生しないようである[ 38] [ 28] バイオアベイラビリティ は低く、これは徹底的な初回通過代謝(特にEMPの脱リン酸化)に起因する[ 1] 吸収 が不完全である可能性が示唆されている[ 1] [ 1] カルシウム 、アルミニウム またはマグネシウム を摂取すると、腸からの吸収が低下するためバイオアベイラビリティが著しく損なわれ、低用量での治療効果が阻害される可能性がある[ 3] [ 18]
前立腺癌の男性にEMP420mgを単回経口投与した処、エストロムスチンの最大値は310~475ng/mLで、2~3時間後に到達した[ 1] [ 3] [ 5] [ 28] [ 1] [ 28] 妊娠 中期から後期にかけての妊婦の血中濃度と同様であるように思われる[ 46] [ 1]
EMPの薬物動態 は、静脈内注射 の場合とは異なる[ 1] [ 1] [ 1] [ 1] 血漿蛋白結合率 は高い[ 1] 腫瘍 組織、例えば前立腺癌 や神経膠腫 組織に蓄積され、これらの組織におけるエストラムスチンレベルは血漿中よりもはるかに高い(例えば、それぞれ6.3-および15.9倍)[ 1] [ 1] 脂肪組織 に蓄積されるようである[ 1]
EMPの経口投与によるエストロムスチンの消失半減期 は平均13.6時間であり、その範囲は8.8時間から22.7時間であった[ 1] [ 1] [ 1] 胆汁 中に排泄 され、その結果、糞便 中に排出される[ 1] [ 28] 尿 中に排泄されることはないと考えられている[ 1]
ヒトにおけるエストラムスチンリン酸エステルの代謝 経路[ 6] [ 1] [ 28] [ 43] [ 44]
EMPは、エストラジオール3-ノルムスチン-17β-リン酸または3-(ビス(2-クロロエチル)カルバミン酸)エストラジオール-17β-(リン酸二水素) としても知られており、合成エストラン ステロイド でエストラジオール の誘導体 である[ 31] [ 16] エストロゲン エステルであり、具体的には、EMPはエストラジオールのC3ノルムスチン(ナイトロジェンマスタード -カルバミン酸 部位)エステルおよびC17βリン酸 エステルのジエステル である[ 31] [ 16] ナトリウム 塩またはメグルミン 塩として提供される[ 31] [ 16] [ 47] [ 31] [ 16] 抗悪性腫瘍薬 としては他に、上市されていないものの、アレストラムスチン (英語版 ) アトリムスチン (英語版 ) 酢酸シテストロール (英語版 ) エストラジオールマスタード (英語版 ) ICI-85966 (英語版 ) フェネストロール (英語版 ) [ 31] [ 16]
リン酸エステル部分の親水性により、EMPは水溶性 の高い化合物である[ 48] [ 49] [ 50] 脂肪酸 エステルなどの親油性 化合物であり、水 にとても溶けがたいのとは対照的である[ 2] イオン化 不可能である[ 20] 静脈内投与 を可能にするために分子内に取り込まれたものである[ 7]
EMPは1960年代半ばに初めて合成 され、1967年に特許を取得した[ 38] 乳癌 の治療薬として開発された[ 1] [ 1] [ 1] 放射性同位元素 で標識されたEMPがラットの前立腺 に取り込まれ蓄積されることが判明し、前立腺癌 の治療に再利用されるに至った[ 1] [ 3] [ 1] [ 3] [ 51] [ 28] [ 28] [ 52]
EMPは、神経膠腫 や乳癌 など、他のがん の治療法として研究されている[ 1] QOL (生活の質)をわずかに改善することが確認されている[ 1]
^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br bs bt bu bv bw bx by bz ca cb cc “Pharmacokinetics and pharmacodynamics of estramustine phosphate”. Clin Pharmacokinet 34 (2): 163–72. (February 1998). doi :10.2165/00003088-199834020-00004 . PMID 9515186 .
^ a b c d e “Pharmacology of estrogens and progestogens: influence of different routes of administration” . Climacteric 8 Suppl 1 : 3–63. (2005). doi :10.1080/13697130500148875 . PMID 16112947 . http://hormonebalance.org/images/documents/Kuhl%2005%20%20Pharm%20Estro%20Progest%20Climacteric_1313155660.pdf .
^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao “Necessity of re-evaluation of estramustine phosphate sodium (EMP) as a treatment option for first-line monotherapy in advanced prostate cancer”. Int. J. Urol. 8 (2): 33–6. (February 2001). doi :10.1046/j.1442-2042.2001.00254.x . PMID 11240822 .
^ a b c “Emcyt (estramustine) dosing, indications, interactions, adverse effects, and more ”. Medscape Reference . WebMD. 8 February 2014 閲覧。
^ a b c d e f g h i j k l m n o p q r s t u v w x y Inoue, Takahiro (2018). “Role of Estramustine Phosphate and Other Estrogens for Castration-Resistant Prostate Cancer”. Hormone Therapy and Castration Resistance of Prostate Cancer . pp. 249–256. doi :10.1007/978-981-10-7013-6_26 . ISBN 978-981-10-7012-9
^ a b c d e f g h i j k l “Estramustine phosphate sodium. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy in prostate cancer”. Drugs Aging 7 (1): 49–74. (July 1995). doi :10.2165/00002512-199507010-00006 . PMID 7579781 .
^ a b c d https://www.accessdata.fda.gov/drugsatfda_docs/label/2008/018045s023lbl.pdf
^ a b “Chemotherapy with or without estramustine for treatment of castration-resistant prostate cancer: A systematic review and meta-analysis” . Medicine (Baltimore) 95 (39): e4801. (September 2016). doi :10.1097/MD.0000000000004801 . PMC 5265899 . PMID 27684806 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5265899/ .
^ a b c d e f g h “The use of estramustine phosphate in the modern management of advanced prostate cancer”. BJU Int. 108 (11): 1782–6. (December 2011). doi :10.1111/j.1464-410X.2011.10201.x . PMID 21756277 .
^ a b c Simpson, D; Wagstaff, AJ (2003). “Estramustine Phosphate Sodium”. American Journal of Cancer 2 (5): 373–390. doi :10.2165/00024669-200302050-00013 .
^ “Estramustine-based chemotherapy”. Semin. Urol. Oncol. 15 (1): 13–9. (February 1997). PMID 9050135 . ^ a b c d “Estramustine revisited”. Cancer Treat. Res. . Cancer Treatment and Research 78 : 163–84. (1995). doi :10.1007/978-1-4615-2007-8_8 . ISBN 978-1-4613-5829-9 . PMID 8595142 .
^ a b c d e f g h Michael Oettel; Ekkehard Schillinger (6 December 2012). Estrogens and Antiestrogens II: Pharmacology and Clinical Application of Estrogens and Antiestrogen ISBN 978-3-642-60107-1 . https://books.google.com/books?id=wBvyCAAAQBAJ&pg=PA540
^ a b c d e “エストラサイトカプセル156.7mg 添付文書 ”. www.info.pmda.go.jp . 2022年1月3日 閲覧。
^ a b c “Androgens and prostate cancer: biology, pathology and hormonal therapy”. Eur. J. Cancer 33 (4): 545–54. (April 1997). doi :10.1016/S0959-8049(96)00444-3 . PMID 9274433 .
^ a b c d e f g Index Nominum 2000: International Drug Directory ISBN 978-3-88763-075-1 . https://books.google.com/books?id=5GpcTQD_L2oC&pg=PA406
^ “Estramustine Uses, Side Effects & Warnings ”. 2022年1月4日 閲覧。 ^ a b c d e f “Estracyt Capsules - Summary of Product Characteristics (SPC) ”. electronic Medicines Compendium . Pfizer Limited (12 August 2013). 8 February 2014 閲覧。
^ Aurel Lupulescu (24 October 1990). Hormones and Vitamins in Cancer Treatment ISBN 978-0-8493-5973-6 . https://books.google.com/books?id=VddUa-2cp-YC&pg=PA40 ^ a b Valentino Stella; Ronald Borchardt; Michael Hageman; Reza Oliyai, Hans Maag, Jefferson Tilley (12 March 2007). Prodrugs: Challenges and Rewards ISBN 978-0-387-49782-2 . https://books.google.com/books?id=qkjHxX5TgHEC&pg=PA174
^ “The use of estrogen therapy in men”. Curr Opin Pharmacol 3 (6): 650–4. (2003). doi :10.1016/j.coph.2003.07.004 . PMID 14644018 . ^ a b “Parenteral estrogen versus total androgen ablation in the treatment of advanced prostate carcinoma: effects on overall survival and cardiovascular mortality. The Scandinavian Prostatic Cancer Group (SPCG)-5 Trial Study”. Urology 55 (3): 328–33. (2000). doi :10.1016/s0090-4295(99)00580-4 . PMID 10699602 .
^ “Estramustine phosphate for preventing flare-up in luteinizing hormone-releasing hormone analogue depot therapy”. Eur. Urol. 27 (3): 192–5. (1995). doi :10.1159/000475159 . PMID 7541359 . ^ “Endocrine treatment of prostate cancer”. J. Steroid Biochem. Mol. Biol. 92 (4): 287–95. (November 2004). doi :10.1016/j.jsbmb.2004.10.005 . PMID 15663992 . ^ “Estrogens in the treatment of prostate cancer”. J. Urol. 154 (6): 1991–8. (December 1995). doi :10.1016/S0022-5347(01)66670-9 . PMID 7500443 . ^ “Addition of estramustine to chemotherapy and survival of patients with castration-refractory prostate cancer: a meta-analysis of individual patient data”. Lancet Oncol. 8 (11): 994–1000. (2007). doi :10.1016/S1470-2045(07)70284-X . PMID 17942366 . ^ “Low-Dose Estramustine Phosphate and Concomitant Low-Dose Acetylsalicylic Acid in Heavily Pretreated Patients With Advanced Castration-Resistant Prostate Cancer”. Clin Genitourin Cancer 13 (5): 441–6. (October 2015). doi :10.1016/j.clgc.2015.03.004 . PMID 25920994 . ^ a b c d e f g h i j k l m n “Clinical pharmacokinetics of estramustine phosphate”. Urology 23 (6 Suppl): 22–7. (June 1984). doi :10.1016/S0090-4295(84)80093-X . PMID 6375076 .
^ a b “Estracyt in advanced carcinoma of the breast: a phase II study”. Clin Radiol 30 (2): 139–47. (March 1979). doi :10.1016/S0009-9260(79)80133-6 . PMID 86404 .
^ a b “Change in white cell count during treatment of advanced cancer of the prostate with estramustine phosphate and with stilboestrol”. Br J Urol 55 (4): 408–12. (August 1983). doi :10.1111/j.1464-410X.1983.tb03333.x . PMID 6349745 .
^ a b c d e f J. Elks (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies ISBN 978-1-4757-2085-3 . https://books.google.com/books?id=0vXTBwAAQBAJ&pg=PA502
^ a b “Androgen antagonistic effect of estramustine phosphate (EMP) metabolites on wild-type and mutated androgen receptor”. Biochem. Pharmacol. 55 (9): 1427–33. (May 1998). doi :10.1016/S0006-2952(97)00657-6 . PMID 10076535 .
^ a b “Effect of estramustine phosphate on free androgens. A comparative study of the effect of orchiectomy and estramustine phosphate on free androgens in patients with prostatic cancer”. Acta Urol Belg 58 (4): 89–95. (1990). PMID 2093302 .
^ a b c “Effects of diethylstilbestrol and estramustine phosphate on serum sex hormone binding globulin and testosterone levels in prostate cancer patients”. J. Urol. 124 (2): 232–6. (August 1980). doi :10.1016/S0022-5347(17)55383-5 . PMID 7190620 .
^ “Recent advances in chemotherapy for advanced prostate cancer”. Curr Urol Rep 1 (1): 48–56. (May 2000). doi :10.1007/s11934-000-0035-z . PMID 12084341 . ^ a b “The oestrogenic effects of ethinyl oestradiol/polyoestradiol phosphate and estramustine phosphate in patients with prostatic carcinoma. A comparative study of oestrogen sensitive liver proteins, gonadotrophins and prolactin”. Br J Urol 58 (4): 412–6. (August 1986). doi :10.1111/j.1464-410X.1986.tb09095.x . PMID 3092893 .
^ Fredholm, B., Jensen, G., Lindskog, M., & Muntzing, J. (1974, January). Effects of estramustine phosphate (Estracyt) on growth of DMBA-induced mammary tumors in rats. In Acta Pharmacologica et Toxicologica (Vol. 35, pp. 28-28). 35 Norre Sogade, PO Box 2148, DK-1016 Copenhagen, Denmark: Munksgaard Int Publ Ltd.
^ a b c “Molecular conformation of estramustine and two analogues” . Mol. Pharmacol. 41 (3): 569–76. (March 1992). PMID 1545778 . http://molpharm.aspetjournals.org/content/41/3/569 .
^ a b “Estramustine phosphate sodium”. Drug Intell Clin Pharm 18 (5): 368–74. (May 1984). doi :10.1177/106002808401800502 . PMID 6373212 .
^ “Estramustine--a nitrogen mustard/steroid with antimicrotubule activity”. Pharmacol. Ther. 43 (3): 299–319. (1989). doi :10.1016/0163-7258(89)90012-0 . PMID 2682681 . ^ Franco Cavalli; Stan B. Kaye; Heine H Hansen; James O Armitage; Martine Piccart-Gebhart (12 September 2009). Textbook of Medical Oncology, Fourth Edition ISBN 978-0-203-09289-7 . https://books.google.com/books?id=WdDKBQAAQBAJ&pg=PA442 ^ “The hydrolysis of estramustine phosphate; in vitro studies”. Eur J Drug Metab Pharmacokinet 8 (4): 395–402. (1983). doi :10.1007/BF03188772 . PMID 6673977 . ^ a b “Single nucleotide polymorphisms of 17beta-hydroxysteroid dehydrogenase type 7 gene: mechanism of estramustine-related adverse reactions?”. Int. J. Urol. 16 (10): 836–41. (October 2009). doi :10.1111/j.1442-2042.2009.02374.x . PMID 19735314 .
^ a b “Single-nucleotide polymorphisms in the 17beta-hydroxysteroid dehydrogenase genes might predict the risk of side-effects of estramustine phosphate sodium in prostate cancer patients”. Int. J. Urol. 12 (2): 166–72. (February 2005). doi :10.1111/j.1442-2042.2005.01004.x . PMID 15733111 .
^ Gate, Laurent; Tew, Kenneth D. (2011). “Alkylating Agents”. Cancer Management in Man: Chemotherapy, Biological Therapy, Hyperthermia and Supporting Measures . pp. 61–85. doi :10.1007/978-90-481-9704-0_4 . ISBN 978-90-481-9703-3 ^ http://www.ilexmedical.com/files/PDF/Estradiol_ARC.pdf ^ Muller (19 June 1998). European Drug Index: European Drug Registrations, Fourth Edition ISBN 978-3-7692-2114-5 . https://books.google.com/books?id=2HBPHmclMWIC&pg=PA245 ^ Thorsteinn Loftsson (25 January 2014). Drug Stability for Pharmaceutical Scientists ISBN 978-0-12-411562-0 . https://books.google.com/books?id=dUzyAQAAQBAJ&pg=PA77 ^ S. Bernal (21 August 1997). Drug Resistance in Oncology ISBN 978-1-4200-0209-6 . https://books.google.com/books?id=x9rL5HiTFTUC&pg=PA287 ^ Samuel J. Murff (20 February 2012). Safety and Health Handbook for Cytotoxic Drugs ISBN 978-1-60590-705-5 . https://books.google.com/books?id=CqIPtcoUiMMC&pg=PA89 ^ William D. Figg; Cindy H. Chau; Eric J. Small (14 September 2010). Drug Management of Prostate Cancer ISBN 978-1-60327-829-4 . https://books.google.com/books?id=4KDrjeWA5-UC&pg=PA402 ^ “エストラサイトカプセル156.7mg インタビューフォーム ”. www.info.pmda.go.jp . 2022年1月6日 閲覧。