|
骨粗鬆症
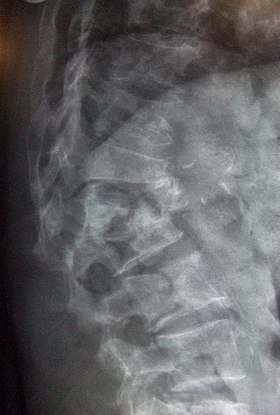
骨粗鬆症(こつそしょうしょう、骨粗しょう症、英: osteoporosis)とは、後天的に発生した骨密度の低下、または骨質の劣化により骨強度が低下し、脆弱性骨折が発生し易くなる疾患、あるいは、そのような骨の状態を指す[1]。なお、英語の「osteoporosis」は「osteo」が「骨の」という意味なので「骨が穴だらけになった状態」といった意味であり、日本語の「骨粗鬆症」は「骨の中身が粗く細かい穴が沢山できた状態」といった意味である。 骨粗鬆症には、そのほとんどを占める老化に伴って発生した原発性骨粗鬆症と、何らかの明白な原因の存在する続発性骨粗鬆症とが有る。後者の続発性骨粗鬆症の明白な原因としては、慢性腎不全などの疾患の存在、ステロイド系抗炎症薬を始めとする医薬品など薬物の長期連用、骨の形成に不可欠な栄養分の摂取不足などが挙げられる。 病態骨はカルシウムの塩などの骨塩(bone mineral content)とコラーゲンを主成分とした骨基質が、整然と配置される事によって強度を保っている。しかし、だからと言って重量が嵩んでも困るので、それぞれの骨に普段から力がかかる方向に強いように、骨基質が配置されている。さらに、骨芽細胞による骨形成と、破骨細胞による骨吸収によって、常に古い骨基質を、新しく作り直すという、いわゆる骨の更新作業(turn-over)によっても、その強度を保っている。長い期間身体の構造を支えていると微小な骨基質に微小な傷が生ずるし、糖化産物などが溜まってくる事で劣化してくるので、この更新作業が行われる。 成長期においては正常であれば骨形成が勝り、ヒトの場合には20歳代で、骨に含まれる骨基質の量、すなわち骨密度はピークを迎える[注釈 1]。また、普段から力がかかる方向に強いように骨基質を配置すべく、力がかかった場所で骨形成が盛んになる仕組みも備えている。 ところが、ここまでの過程で、骨形成に必要な栄養素を充分に摂取せず、さらに、適度な力をかけていなかった場合には、たとえ20歳代であっても、あまり骨密度が高くならない場合が有る[注釈 2]。その上に、加齢に伴って誰でも次第に骨形成の速度は衰えてくる。加えて、ヒトではエストロゲンが破骨細胞を抑制しているのだが、女性では閉経によってエストロゲンは激減し、男性でも非常に高齢になるとエストロゲンも減少するため、骨吸収が盛んになってくる。骨粗鬆症は、骨形成に対する骨吸収の相対的な亢進によって、骨が脆弱になった病態である。 なお、女性は男性に比べて元来の骨量が少ないため、形成・吸収のバランスが崩れた時に、症状が表面化し易い。この症状の表面化こそが脆弱性骨折である。大腿骨や椎体骨の骨折は、いわゆる高齢者の寝たきりの原因の1つであり、これらの骨折によって生活の質(QOL)は著しく低下する。 一方で、脆弱性骨折が発生する前は、特に自覚症状の無いまま、次第に骨の強度が低下している場合も有る。20歳代の平均的なヒトの骨密度に比べて、どれだけ骨密度が低下したのかを指すYAMやTスコアが、しばしば骨粗鬆症の指標の1つとして用いられる。 疫学日本では厚生労働省などによると、国内の患者数は、高齢者の割合の増加に伴って年々増加しており、自覚症状の無い未受診者を含めると、推計で1100万人を超えるとされている。高齢の女性に多く、患者の8割は女性である。60歳代女性の3人に1人、70歳代女性の2人に1人が、骨粗鬆症の可能性があるとされる。初期段階に自覚症状は無く、骨折して初めて気付くケースも少なくない。 アメリカ合衆国では3000万人に症状が現れていると考えられている。 分類骨粗鬆症は大きく原発性骨粗鬆症と続発性骨粗鬆症に分けられる。 原発性骨粗鬆症原発性骨粗鬆症とは、閉経や老化に伴って発症した骨粗鬆症を指す。骨粗鬆症のほとんどは原発性骨粗鬆症で、エストロゲン低下に伴って、破骨細胞の抑制が効かなくなる事が主な原因である。なお、老化のために発生した老人性骨粗鬆症や、女性の閉経後に発生した閉経後骨粗鬆症などに細分される場合も有る。 女性では閉経後骨粗鬆症が多く、閉経すると卵巣で産生されるエストロゲン分泌量が激減するため、破骨細胞の抑制が効かなくなり、結果として、ほとんどの女性に骨密度の低下が認められる[注釈 3]。女性である事それ自体が骨粗鬆症の発症リスクなので[注釈 4]、成長期の間に充分に骨に骨塩を蓄えるように生活する事で、その後に少々の骨密度の低下が発生しても、物ともしない骨を作っておく事が望まれる。また、骨密度が最大に達した20歳代を過ぎてからは、可能な限り骨密度が低下しないような生活習慣を心掛ける必要が有る。 なお、骨粗鬆症は女性に多いものの、男性だから発症しないというわけではない。男性の場合も、加齢は骨量の減少要因の1つである。高齢の男性ではテストステロンの量が減少するためエストロゲン量も減少し、骨密度の低下につながると考えられている[注釈 5]。男性でも骨密度の低下と血中エストロゲン量には、相関が有る事も示されている[2]。 続発性骨粗鬆症続発性骨粗鬆症とは、何らかの疾患や、その治療のために長期にわたって薬物使用を行った場合など、その背景に疾患が絡って発症した骨粗鬆症を指す。骨粗鬆症を引き起こす疾患としては、例えば、慢性腎不全によってビタミンDの活性化が不能になった病態、糖尿病によって発生した高血糖の状態が骨の質を低下させた病態などが挙げられる。また、手術による胃の切除などによって、カルシウムを吸収し難くなった状態も、骨粗鬆症を招く。 なお、疾患の治療のために薬を長期間使用した結果として、骨粗鬆症を発症させ得る薬の種類は、多数存在する。それらの中でも、何らかの原因で発症した全身性の激しい炎症などの抑制のために、ステロイド系抗炎症薬を長期連用したため骨粗鬆症を発症したケースは有名である。
喫煙の悪影響喫煙は、骨に直接的・間接的に様々な機序で作用し、骨粗鬆症を促進する。直接作用としては、ニコチンが骨細胞に毒として働くことが指摘されている[6][7]。さらに、煙草の煙中のカドミウムも骨に悪影響を与える[8]。間接的作用としては、小腸からのカルシウム吸収の減少[9]、ビタミンDの減少[10]、性ホルモン代謝の変化[11][12][13]、非喫煙者よりも低い体重[14][15]、非喫煙者よりも早い閉経[16]、非喫煙者に比べて低い身体活動度[17]などである。これらの直接的・間接的影響によって、喫煙者は非喫煙者に比べて、オステオカルシンなどの骨形成マーカーが低く、骨粗鬆症を来たし易いとされている[18][19]。 ガイドライン診療ガイドラインの国際標準の作成手順とされているGRADEを用いて作られたガイドラインは、NICEガイドラインとUSPSTFのみである。 骨粗鬆症の診療ガイドラインには、日本の骨粗鬆症の予防と治療ガイドライン作成委員会が作成した『骨粗鬆症の予防と治療ガイドライン2015年版』の他に、イギリスのNICEガイドラインとSIGNガイドライン、アメリカ合衆国のICSI、NOF、USPSTFが有る。また、ステロイド骨粗鬆症では日本骨代謝学会が『ステロイド性骨粗鬆症の管理と治療ガイドライン2014年改訂版』を作成しており、アメリカ合衆国には2010年に改訂された『米国リウマチ学会のステロイド骨粗鬆症の予防と治療の推奨[20]』を発表している。 骨粗鬆症のスクリーニング対象日本の『骨粗鬆症の予防と治療ガイドライン2015年版』に、骨粗鬆症のスクリーニング対象者の記載は無い。USPSTFでは65歳以上の女性をスクリーニング対象としている。慣習的に65歳以上の女性、65歳未満でステロイド系抗炎症薬の全身投与を行う予定を有する男女、転倒やふらつきのリスクを有する男女をスクリーニング対象とする場合が多い。スクリーニングでリスク評価をする項目は、骨密度の測定と骨折リスク評価ツールであるFRAXを用いる。その結果以下の4パターンでは薬物療法の適応と考えられるが、これらの基準は絶対的な物ではない。例えば、寝たきりで転倒する機会が乏しい場合、余命が限られているため、服薬が困難な場合は治療する意義は乏しくなる。
検査骨密度測定日本では性別ごとの若年成人平均値(young adult mean、YAM)を基準値として何%かで算出される。これに対して欧米では若年女性(20 - 29歳)の骨密度を基準とした標準偏差値であるTスコアを用いる。Tスコアの-2.5がYAM70%に相当する。なお同年齢との比較はZスコアで行われる。 DXA(dual-energy X-ray absorptiometry、躯幹骨2重X線吸収法)DXAまたはDEXAと呼ばれる骨密度測定法は2種類の異なるX線を骨に照射して、骨と他の組織におけるX線の吸収率の差から骨密度を測定する方法である。DXAは正確に骨密度を測定できる方法としてWHOの基準に組み込まれており、2017年現在、骨粗鬆症の標準的な診断方法とされている。骨塩定量とも言う。 測定部位はJCS2015では腰椎(L1 - L4またはL2 - L4)と大腿骨近位部の両方を測定する事が推奨されている。 DXAの診断特性はTスコア-2.5以下を基準とした場合、椎体骨折の有無に対して腰椎のDXAは、感度71.2%で特異度97.2%であった。大腿骨近位部のDXAでは感度33.8%で特異度が97.2%であった。椎体骨折に関しては椎骨のDXAの方が望ましい。なお、椎体圧迫骨折が有ると見かけ上の骨密度が高くなるため、椎骨のDXAを用いる場合には、予め腰椎レントゲン写真撮影で圧迫骨折が無い事の確認が必要である。 日本骨代謝学会によるフローチャートによると、腰椎側面のX線撮影で病的骨折が認めなければ、骨塩定量を行なう事としている。若年成人平均値(YAM)を基準値として、70%未満であれば、どの部位であっても骨粗鬆症と診断する。測定部位は腰椎、大腿骨、橈骨、第二中手骨、踵骨いずれでも良いとされているが、最も望ましい部位は、腰椎とされている。YAM70%-80%の範囲では、骨粗鬆症ではなく、単に「骨量減少」とする。橈骨ではビスホスホネート(ビスフォスフォネート)の治療効果判定ができない。超音波を使用した骨密度定量は結果のばらつきが大きく、骨粗鬆症の診断に使用するのは適切ではないとして、適正な測定方法に含まれていない。高齢女性においては、二重エネルギーX線吸収法(DXA法)は骨折予測にあまり有用でないという報告も存在する[21]。 MD法、DIP法手の骨と、階段状に加工したアルミニウム板とを同時にX線撮影し、骨とアルミニウム板とのX線の透過度を比べる事によって骨密度を測定する。 QCT法、pQCT法CTを用いて、骨を撮影する。 QUS法超音波を用いて骨密度を測定する。X線による被曝の恐れが無い。 FRAX(Fracture Risk Assessment Tool)FRAX は2008年にWHOから、10年以内の大腿骨近位部骨折と主要な骨粗鬆症性骨折(大腿骨近位部骨折、上腕骨近位部骨折、橈骨遠位端骨折、臨床的椎骨骨折)のリスク評価するためのツールとして提唱された。FRAXによる骨折リスクの評価は、欧米・アジア・オーストラリアでの10コホート研究から検討された12項目の骨折危険因子から計算される。対象年齢は40 - 90歳成人で、危険因子は年齢、性別、体重、身長、骨折歴、両親の大腿骨近位部骨折歴、現在の喫煙、ステロイドホルモン薬使用、関節リウマチ、続発性骨粗鬆症、1日3単位以上の酒の摂取、大腿骨近位部骨密度からなる。リスクとしては大腿骨近位部骨折の家族歴が最も高く、関節リウマチ、ステロイドホルモン薬の使用、骨粗鬆症性骨折の既往が続く。 JPOS(Japanese Population-Based Osteoporisis)では日本語版FRAXで計算された10年以内の骨折リスクと実際に10年間フォローアップした際の骨折率を比較した比較し、両者に大きな差は認められなかった。FRAXは日本の医療現場でも実用可能と考えられる。FRAXには大腿骨近位部の骨密度の項目があるが、この項目は使用しなくとも計算された骨折リスクに大きな影響は与えていない。そのため骨密度が測定できない診療所でも利用可能である。FRAXの問題点としては以下の7項目が指摘されている。まずは制作過程が明らかにされていないこと。入力できる骨密度は大腿骨近位部に限られているため、椎体骨折の評価としては不充分な可能性があること。骨折リスクの1つであるステロイドホルモン薬の使用量と使用期間が考慮されないこと。大腿骨近位部骨折の最大の原因である転倒が、危険因子に含まれていないこと。骨折歴では骨折数や部位が考慮されていないこと。プロトンポンプ阻害薬、抗うつ薬、抗凝固薬、ループ利尿薬など、その他の骨折リスクを上げる薬剤の使用が考慮されていないこと。40 - 90歳成人を対象としているツールなのでそれ以外の年齢では利用できないことが挙げられる。 骨代謝マーカー骨吸収マーカーであるDPDやNTX、TRACP-5bおよび、骨形成マーカーBAP、P1NPが知られている。 予防人種、体型、運動不足、喫煙、食事内容、酒の摂取などが、骨粗鬆症の要因として知られる。人種ではアフリカ系が骨粗鬆症を発症し難い。運動の習慣が無く、痩せた体型、低い身長は危険因子の1つである。骨形成に欠かせないカルシウムの吸収を阻害するピロリン酸などの過剰摂取、ビタミンDやビタミンKの不足した食事、カフェインの摂り過ぎ、過剰な飲酒は、食事面における危険因子である。喫煙は#喫煙の悪影響によって危険因子となる。 骨粗鬆症を予防するには、これらの要因を除去する事、具体的には発症前の運動と食物の内容が重要である。この他に、宇宙飛行士に当該症状が起こり易い。無重力が関係していると言われており、宇宙空間に6か月滞在する事により、骨密度は10%失われる。宇宙食や運動や投薬で防ぐ研究が行われている。骨粗鬆症の治療と予防のガイドライン[22]によれば、骨粗鬆症の予防には以下の項目が推奨されている。
世界保健機構 (WHO) は、2002年に動物性蛋白質による酸性の負荷、およびナトリウムが増えると、カルシウム必要量が増加することに言及し[23]、2007年にはタンパク質による酸負荷があり、カリウムを含む野菜や果物によるアルカリ化は骨の健康に有益な影響がある[24]。野菜と果物の摂取量が多いほど骨密度が高いという研究結果が老若男女それぞれにある[25][26][27][28]。様々な意味で用いられるカルシウム・パラドックスについては当該記事を参照。 治療食事・運動療法日本人の平均カルシウム摂取量と平均ビタミンD摂取量は厚生労働省の食事摂取基準の推奨量によりも少ない実態があることから、 骨粗鬆症の患者にはカルシウムとビタミンDの補充を行う場合がある。ビタミンD血中濃度測定はカルシジオール(25(OH)D)の濃度で評価し、15ng/ml(37.5 nmol/l)以上であれば充分とされている。食事ではカルシウムは乳製品、マイワシ、干しえび、シジミなどに、ビタミンDはマイワシなどの魚と椎茸やキクラゲなどのキノコ類に多く含まれている。またビタミンDは紫外線に当たると皮膚で非酵素的に生成するため、肝障害と腎障害が無ければ日光浴も方法の1つである[注釈 6]。一般的には冬期では1日当たり20分-2時間、夏期では5-10分くらい日光に当たると良いとされている。しかし天候や緯度にもよるので一概には言えない。屋外で運動療法を行うことで、必要な量の紫外線を浴びてビタミンDを合成することが可能である。 運動療法の主な目的は骨密度上昇、背筋強化、転倒予防などにより骨折予防をはかることである。実施にあたっては転倒を予防するなど安全性を考慮に入れた上で行う[22]。 転倒予防転倒予防では多因子介入を行う。向精神薬(特にベンゾジアゼピン系薬)、降圧薬、糖尿病治療薬、薬剤性パーキンソン症候群を起こすような薬剤など、ふらつき・転倒の原因になる薬剤の減量や中止を検討して、ポリファーマシー(多剤併用)を解消する。転倒の原因となる白内障や緑内障を積極的に検索する。夜間の排尿も転倒のリスクになるため排尿障害も積極的に検索する。筋力トレーニングやバランス強化トレーニング、耐久性訓練などを組み合わせた運動療法は転倒率を20%程度抑制し、QOLを改善させるという報告もある。 薬物療法骨粗鬆症は下記の4種類の薬剤(ビスフォスフォネート系薬剤、SERMおよび女性ホルモン、抗RANKL抗体、テリパラチド)の中から1つを選択して行われる。日本での保険診療では、4種類の中の複数を重複投与できないと定めている。また女性ホルモン、ラロキシフェン、バゼドキシフェンは閉経後の女性のみに有効である。
上記は骨粗鬆症の予防と治療ガイドライン作成委員会における推奨度である。Aは強く勧められる、Bは勧められる、Cは勧められる根拠がないとされている薬である。2016年時点では、さらに新しいガイドラインが発表されており、上記は古いガイドラインである。 ビスフォスフォネート系薬剤→「ビスホスホネート」も参照
ビスホスホネート(BP)は骨組織に付着することで破骨細胞に取り込まれる。BPを取り込んだ破骨細胞はアポトーシスに至り骨吸収が抑制される。その結果骨密度が上昇し、骨折の予防につながる。側鎖に窒素を含まない第1世代のエチドロン酸、側鎖に窒素を含むが環状構造を有さない第2世代のアレンドロン酸、イバンドロン酸、側鎖に窒素を含み環状構造を有する第3世代のリセドロン酸、ミノドロン酸がある。第2、第3世代のBPは、第1世代と異なる機序で骨吸収を抑制するため、1000倍から10000倍も効果が高いと言われている。BPにはゾレドロン酸という点滴薬もあるが、悪性腫瘍による高カルシウム血症で用いられる[29]。日本では骨粗鬆症と指摘された場合、脆弱性骨折を起こした場合、他疾患でステロイドホルモン薬の全身投与を導入され、骨粗鬆症予防が必要とされた場合にBPは投与される。日本のガイドラインではBPのうち、特にアレンドロン酸とリセドロン酸を第1選択として推奨している。 なおクレアチニンクリアランスで30 ml/min未満ではBPは使用禁忌であるため、腎機能障害を有する場合は投与できない。 効果骨密度に関しては椎体および大腿骨近位部の骨密度を上昇させる。骨密度は投与開始から5%程度の改善があり、その後はプラトーとなる。骨折の一次予防に関してはあまり効果なく、骨折の二次予防に関しては椎体骨折、非椎体骨折、大腿骨近位部骨折のいずれも減らすことができ、かなり効果が期待できる。骨折時は座位保持が困難な場合もあるのでBPを安全に服薬できるようになったら速やかに内服を開始する。BPを投与開始し6 - 12か月で椎体骨折の予防効果が出現し、12 - 18か月以降になって、初めて大腿骨近位部骨折を含む非椎体骨折の予防効果が現れる。長期的な骨折予防効果が持続するかは不明である。 BPの効果を検証した研究のほとんどはカルシウム製剤と活性型ビタミンD3製剤を併用している。そのため、BPを開始する際は活性型ビタミンD3製剤(ワンアルファならば0.5 μg/dayから1.0 μg/day程度)を併用する。必要があればカルシウム製剤も併用する。 アメリカ食品医薬品局(FDA)はBPによる大腿骨非定形骨折のリスク増加を受けて、5年以上使用する場合には継続するべきか再検討するように2010年に警告している。休薬のプロトコールとしてはUK NOGGの物が知られている[30]。 副作用
→「ビスホスホネート系薬剤関連顎骨壊死」も参照
SERMおよび女性ホルモン
抗RANKL抗体
破骨細胞の活動を強力に抑制するため、カルシウムの貯蔵庫としての役目を果たしている骨からのカルシウム供給が滞るため、 血中のカルシウムが低下し易い。したがって、原則としてビタミンD・カルシウム・マグネシウムの合剤(デノタス錠)の併用が必要である。 非常に高い骨密度の改善効果を持つ。
副甲状腺ホルモン
抗スクレロスチン抗体
補助的な治療薬下記は補助的に使用される薬剤である。

経皮的椎体形成術椎骨が圧迫骨折に至った場合は、骨セメントを注入して潰れた箇所を整復する経皮的椎体形成術が行われる場合がある[32]。 ステロイド骨粗鬆症病態一般的な骨粗鬆症と、ステロイド骨粗鬆症は病態が異なると考えられている。 エストロゲンは直接破骨細胞による骨吸収を抑制し、NF-κB活性化受容体リガンド(receptor activator of NF-κB ligand、RANML)の発現を抑制し、破骨細胞の分化も抑制する。閉経後の女性の骨粗鬆症ではエストロゲンの分泌低下によって前述の抑制がなくなることや加齢によって骨吸収の増加が起こることで骨量が減少する。しかし、ステロイド骨粗鬆症では骨細胞と骨芽細胞のアポトーシスが主な病態である。骨細胞と骨芽細胞のアポトーシスにより骨形成が抑制され骨量に加え骨質も低下する。ステロイド骨粗鬆症では始めに骨の内部の海綿骨の骨量・骨質が低下し、椎体圧迫骨折を起こす。後に外側の皮質骨にも影響が出て大腿骨頸部骨折や転子部骨折を起こす。 同じ骨密度でもステロイド使用者は非使用者よりも骨折のリスクが高い。またステロイド骨粗鬆症の骨折リスクは全身に投与したステロイドホルモン薬の用量依存性で、総投与量よりも現在量が骨折のリスクに相関する。 治療ステロイド骨粗鬆症に関しては日本骨代謝学会が『ステロイド性骨粗鬆症の管理と治療ガイドライン2014年改訂版』を作成している[33]。またアメリカ合衆国では2010年に改訂された『米国リウマチ学会のステロイド骨粗鬆症の予防と治療の推奨』が発表された[20]。ステロイド骨粗鬆症の予防、治療において何よりも大切なことは全身性ステロイドの使用量、使用期間をできるだけ少なくすることである。局所に適用するステロイドホルモン製剤や、異なる機序の薬を用いるなどして、全身性ステロイドの使用量を減らせないか常に考えることが必要である。 2010年に改訂された『米国リウマチ学会のステロイド骨粗鬆症の予防と治療の推奨』では何mgまでのステロイドホルモン薬であれば、骨密度を減らさない、骨折率を上げないというような安全域はないため、全身性ステロイドを3か月以上使う見込みのある人全員に生活指導をするように推奨している。生活指導をした上で「閉経後女性または50歳以上の男性」「閉経前女性または50歳以下の男性」に分けて治療推奨が示されている。 生活指導と評価2010年に改訂された『米国リウマチ学会のステロイド骨粗鬆症の予防と治療の推奨』では以下のような生活指導と評価が、全身性ステロイドを3か月以上用いる場合は必要とされている。
なお、カルシウム製剤と活性型ビタミンD3製剤の併用は通常は行わない。 閉経後女性または50歳以上の男性の場合閉経後の女性または50歳以上の男性の場合はFRAXで骨折リスクを計算する。10年以内の主要な骨折リスクが10%未満の時を低リスク、10 - 20%のとき中リスク、20%より大きい場合とTスコア≦-2.5の場合と脆弱性骨折の既往がある場合を高リスクと層別化する。低リスク群で全身性ステロイドを3か月以上使用が見込まれない場合、薬物療法は推奨されない。3か月以上使用が見込まれる場合でもプレドニゾロン7.5 mg/day相当に満たない場合は、薬物療法は推奨されない。しかしプレドニゾロン7.5 mg/day相当以上の場合はアレンドロン酸、リセドロン酸、ゾレドロン酸の利用を推奨する。中リスク群で全身性ステロイドを3か月以上使用が見込まれない場合、薬物療法は推奨されない。3か月以上使用が見込まれる場合は薬物療法が推奨される。プレドニゾロン7.5 mg/day相当に満たない場合は、アレンドロン酸やリセドロン酸の投与が推奨される。プレドニゾロン7.5 mg/day相当以上の場合はアレンドロン酸、リセドロン酸、ゾレドロン酸の投与が推奨される。高リスクではプレドニゾロン5 mg/day相当以上の量を1か月未満の場合はアレンドロン酸、リセドロン酸、ゾレドロン酸の投与を推奨する。またプレドニゾロン5 mg/day相当に満たない量を、1か月以上またはどの用量に関わらず1か月以上ステロイドを使用の場合はアレンドロン酸、リセドロン酸、ゾレドロン酸、テリパラチドの投与を推奨する。 閉経前女性または50歳以下の男性の場合閉経前女性または50歳以下の男性の場合の場合、脆弱性骨折の有無と挙児希望の有無とステロイドホルモン薬の投与期間と投与量で薬物療法は決定する。まず脆弱性骨折がない場合は充分なデータが無い。挙児希望がある場合は長期使用の安全性や胎児への安全性が確立していないため骨粗鬆症治療薬の投与は推奨されない。脆弱性骨折がある場合は50歳以下の男性や挙児希望のない女性の場合はステロイドホルモン薬の使用期間が1 - 3か月でプレドニゾロン5 mg/day相当以上の量を使用する場合はアレンドロン酸やリセドロン酸の投与を推奨する。プレドニゾロン7.5 mg/day相当以上の量使用する場合はゾレドロン酸も推奨される。ステロイドホルモン薬の使用期間が3か月以上の場合は、アレンドロン酸、リセドロン酸、ゾレドロン酸、テリパラチドの投与が推奨される。 脆弱性骨折がある挙児希望のある女性の場合はステロイドホルモン薬の使用期間が1 - 3か月の場合は骨粗鬆症治療薬投与のコンセンサスは無い。ステロイドホルモン薬の使用期間が3か月以上の場合で、プレドニゾロン7.5 mg/day相当以上の量使用する場合は、アレンドロン酸、リセドロン酸、テリパラチドの投与が推奨される。プレドニゾロン7.5 mg/day相当に満たない量使用する場合は、骨粗鬆症治療薬投与のコンセンサスは無い。 ステロイド骨粗鬆症の注意点ステロイド骨粗鬆症はプレドニンゾロン7.5 mg/day以上の内服をしている群では、早期から骨折リスクが高いという報告があることから、ステロイド開始直後からステロイド骨粗鬆症の予防は必要と考えられている[34]。FRAXが普及する以前によく用いられていた治療対象者は、プレドニゾロン5 - 7 mg/day相当量以上、使用期間3か月以上、Tスコア-1.0から-1.5以下であった[35]。またステロイド骨粗鬆症による骨折リスクが高リスクの場合は、ビスフォスフォネート製剤の長期投与はやむをえないと考えられている。比較的リスクが高いステロイド骨粗鬆症においてテリパラチドはアレンドロン酸よりも腰椎骨密度を高めることが示されており、新規圧迫骨折を防ぐ可能性が示唆されているものの、椎体以外の骨折に対する有用性は示されていない。 ステロイド骨粗鬆症の場合は定期的な骨密度の測定などのモニタリングが必要である。またステロイド骨粗鬆症で骨折が起きた場合はテリパラチドを投与することがある。 関連項目
脚注注釈
出典
参考文献
外部リンク
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||