|
Reattivi di organo-alluminio 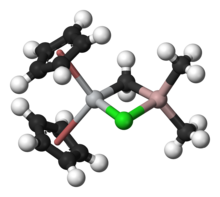 I reattivi di organo-alluminio o composti organo-alluminio sono specie chimiche che contengono un legame diretto tra un atomo di carbonio e uno di alluminio. Sono composti di notevole interesse nell'ambito della chimica metallorganica sia dal punto di vista teorico che applicativo e industriale.[1][2][3][4] Alcuni esempi di composti organo-alluminio sono i dimeri di trimetilalluminio e di idruro di diisobutilalluminio, e il reattivo di Tebbe. Il comportamento generale di questi composti può essere compreso considerando la polarità del legame alluminio-carbonio e la forte acidità di Lewis delle specie tricoordinate. Sono tra i composti organometallici più importanti dal punto di vista industriale; si utilizzano nella sintesi di alcheni, polietilene, polipropilene e altri polimeri, alcoli, prodotti farmaceutici, materiali ceramici e elettronici.[3] StoriaIl primo composto organo-alluminio, (C2H5)3Al2I3, fu sintetizzato da Hallwachs e Schafarik nel 1859 a partire da alluminio e ioduro di etile.[5] Tali composti attirarono ben poco interesse per quasi un secolo, finché nel 1953 Karl Ziegler e collaboratori scoprirono la sintesi diretta di composti trialchilalluminio e li utilizzarono come catalizzatori nelle reazioni di polimerizzazione dell'etilene.[6] Nel giro di dieci anni vi fu uno sviluppo tumultuoso della chimica di questi composti e ne seguirono svariate applicazioni. Nel 1967 gli Stati Uniti produssero oltre 50 tonnellate di reattivi di organo-alluminio.[4] Nel 1977 Walter Kaminsky, Hansjörg Sinn e collaboratori scoprirono l'attività catalitica dei sistemi metallocene-metilalluminossano (MAO) nella polimerizzazione di olefine,[7] aprendo la via a processi più efficienti e a nuove strutture polimeriche.[8] Nel 1988 Werner Uhl sintetizzò i primi composti contenenti legami Al–Al, dove l'alluminio ha stato di ossidazione formalmente minore di +3.[9][10] Composti alchilici di alluminio(III)Struttura La struttura di questi composti è dettata dalla tendenza dell'alluminio a raggiungere la coordinazione quattro; nei composti trialchilici tipo AlR3 questo viene di regola ottenuto formando dimeri Al2R6. Ad esempio il trimetilalluminio forma dimeri contenenti centri Al tetracoordinati, collegati da leganti a ponte metile dove l'atomo di carbonio diventa pentacoordinato (vedi figura). Nei derivati contenenti leganti idruro o alogenuro, il ruolo di legante a ponte è giocato da questi leganti più piccoli, come si vede nel caso dell'idruro di diisobutilalluminio. La dimerizzazione può essere contrastata usando gruppi R molto ingombranti come isopropile o isobutile. In solventi non coordinanti si osserva un equilibrio tra le forme monomera e dimera, e al crescere dell'ingombro del gruppo R la formazione del dimero è sempre più sfavorita.[3][4]
SintesiComposti trialchiliciIndustrialmente si possono ottenere per sintesi diretta di alluminio con idrogeno e alcheni. L'alluminio polverizzato viene fatto reagire dapprima con idrogeno in presenza di un reattivo di trialchilalluminio come attivatore. Si forma un legame Al–H, che poi viene addizionato al doppio legame di un alchene terminale (idroalluminazione). La reazione complessiva risulta:[3][4]
Alternativamente si preparano passando per i corrispondenti sesquicloruri. Ad esempio il trimetilalluminio è preparato partendo con l'alchilazione di alluminio in polvere:
Il prodotto (CH3)3Al2Cl3, chiamato sesquicloruro di metilalluminio,[11] è quindi convertito a trimetilalluminio tramite riduzione con sodio:[3][4]
Alogenuri di alchilalluminioIndustrialmente il modo più importante per preparare alogenuri di alchilalluminio è la reazione tra composti trialchilici di alluminio (R3Al) e alogenuri di alluminio (AlX3). Queste reazioni sono chiamate reazioni di ridistribuzione (redistribution)[4] o di riproporzione (reproportionation)[3], e forniscono prodotti differenti a seconda dei rapporti stechiometrici dei reagenti. Un esempio è nella sintesi del cloruro di dietilalluminio e del dicloruro di etilalluminio:
ReattivitàI composti alchilici di alluminio(III) sono sostanze incolori, molto reattive, che si infiammano spontaneamente all'aria e reagiscono violentemente con l'acqua. A seconda del peso molecolare possono essere liquidi o solidi e sono solubili in idrocarburi alifatici o aromatici. La spiccata reattività di questi composti è dovuta a vari fattori: la debolezza e labilità del legame Al–C, la sua forte polarizzazione (Alδ+–Cδ–), l'esotermicità delle reazioni di ossidazione e idrolisi.[4] I reattivi di organo-alluminio sono acidi di Lewis più forti dei corrispondenti composti di boro, e formano addotti con basi come piridina, tetraidrofurano e ammine terziarie, dove il centro di alluminio raggiunge la coordinazione tetraedrica. Con composti come alcoli, acidi (e acqua) reagiscono anche violentemente, liberando l'alcano. Ad esempio con gli acidi:[1]
Le reazioni di inserzione sono molto comuni.[4] L'ossigeno si inserisce facilmente nel legame carbonio-alluminio tramite una reazione radicalica esotermica che porta agli alcossidi:[3]
Danno inserzione anche semplici molecole ossigenate come CO2, SO2 e SO3. Ad esempio:
Altre reazioni di inserzione sono quelle con alcheni e alchini nel legame Al–H (idroalluminazione, già menzionata) e Al–C (carboalluminazione). Usando etilene la carboalluminazione può portare a una reazione di crescita, utilizzata per produrre alcheni e alcoli terminali a catena lunga:[4]
ApplicazioniL'industria chimica utilizza ogni anno centinaia di migliaia di tonnellate di reattivi alchilalluminio, per applicazioni sia stechiometriche che catalitiche.[3]
AlchilalluminossaniGli alchilalluminossani sono composti che contengono almeno un ossigeno a ponte tra due centri alluminio con sostituenti organici. Il più noto è il metilalluminossano, composto di formula generale (Al(CH3)O)n. Si tratta di sostanze di composizione e struttura poco definita, con strutture cicliche o polimeriche contenenti legami Al–O–Al.[4] Vengono in genere prodotti per idrolisi parziale controllata dei composti di alchilalluminio:
A temperatura ambiente sono sostanze viscose o solide, molto reattive nei confronti dell'acqua, dell'ossigeno e dei composti ossigenati o alogenati. Di solito vengono commercializzate e utilizzate in soluzione di idrocarburi. Vengono usati come cocatalizzatori nella polimerizzazione di olefine, anche per produrre polimeri stereoregolari. La loro funzione è principalmente quella di attivare i catalizzatori veri e propri (derivati ciclopendadienilici di titanio, zirconio e afnio), ma servono anche a catturare impurità. Rispetto ai composti alchilalluminio, l'uso di alchilalluminossani ha il vantaggio di portare a polimeri con minor dispersione del peso molecolare, producendo materiali con caratteristiche migliori.[3] Composti organo-alluminio ridottiLa chimica organometallica dell'alluminio si basa principalmente su composti dove l'alluminio è nello stato di ossidazione +3, ma esistono anche specie dove l'alluminio ha stato di ossidazione formalmente minore di +3, data la presenza di legami Al–Al. Il primo di questi composti ad essere sintetizzato fu (((Me3Si)2CH)2Al)2, contenente un singolo legame Al–Al. Questi composti si ottengono riducendo cloruri di dialchilalluminio con potassio metallico.[10]
Sono note anche strutture più complesse. Il composto (Cp*Al)4 contiene quattro atomi di alluminio(I) che formano un cluster centrale tetraedrico simile a quello dell'idrocarburo platonico tetraedrano.[12] Il cluster [Al12(i-Bu)12]2− è basato su una struttura icosaedrica Al122− simile a quella dell'anione dodecaborato [B12H12]2−.[13] Note
Bibliografia
Altri progetti
|
Portal di Ensiklopedia Dunia