|
Ossido di niobio
L'ossido di niobio(V), o pentossido di niobio, è un composto inorganico con formula Nb2O5 ed è l'ossido del niobio (V). È un solido insolubile incolore ed è abbastanza non reattivo. È il principale precursore di tutti i materiali fatti di niobio. Oltre al pentossido, il niobio può formare anche monossido (NbO) e diossido (NbO2). L'applicazione più importante è nelle leghe, ma altre applicazioni specializzate includono condensatori, niobato di litio e vetro ottico[3] Struttura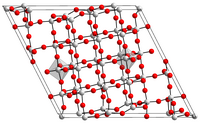 Ha molte forme polimorfiche tutte basate in gran parte su atomi di niobio coordinati ottaedricamente[4][5] I polimorfi sono identificati con una varietà di prefissi[4][5]. La forma più comunemente incontrata è la monoclina H-Nb2O5 che ha una struttura complessa, con una cella unitaria contenente 28 atomi di niobio e 70 di ossigeno, e dove 27 atomi di niobio sono coordinati ottaedricamente e uno tetraedricamente[6]. Esiste un idrato solido non caratterizzato, , il cosiddetto acido niobico (precedentemente chiamato acido columbico), che può essere preparato per idrolisi di una soluzione basica di pentacloruro di niobio oppure da ossido di niobio(V) disciolto in acido fluoridrico[7]. Il pentossido di niobio fuso ha numeri di coordinazione medi inferiori rispetto alle forme cristalline, con una struttura che comprende principalmente poliedri NbO5 e NbO6[8]. ProduzioneIdrolisiL'ossido di niobio(V) viene preparato mediante idrolisi di niobati di metalli alcalini, alcossidi o fluoruro utilizzando delle basi. Tali procedure apparentemente semplici forniscono ossidi idrati che possono poi essere calcinati. Il pentossido di niobio puro può anche essere preparato mediante idrolisi di cloruro di niobio(V):[9] È stato riportato un metodo di produzione tramite tecniche sol-gel che idrolizza gli alcossidi di niobio in presenza di acido acetico, seguito dalla calcinazione dei gel per produrre la forma ortorombica[4], T-Nb2O5[10]. OssidazioneDato che l'ossido di niobio(V) è il composto più comune e robusto del niobio, esistono molti metodi per la sua formazione. L'ossido, ad esempio, si forma quando il niobio metallico viene ossidato nell'aria[11]. L'ossidazione del diossido di niobio (NbO2) nell'aria, forma il polimorfo, L-Nb2O5[12] . Particelle di pentossido di niobio di dimensioni nanometriche sono state sintetizzate mediante riduzione in idruro di litio (LiH) da cloruro di niobio(V), seguita da ossidazione aerea come parte di una sintesi di niobati nanostrutturati.[senza fonte] Reazionil'ossido di niobio(V) viene attaccato da acido fluorifrico e si dissolve in alcali fusi[7][11]. Riduzione a metalloLa conversione di ossido di niobio(V) è la via principale per la produzione industriale di niobio metallico. Negli anni '80 venivano consumati annualmente circa 15.000.000 di kg di Nb2O5 per la riduzione a metallo[13]. Il metodo principale è la riduzione di questo ossido con l'alluminio: Un percorso alternativo, ma meno praticato, prevede la riduzione carbotermica, che procede tramite riduzione con carbonio e costituisce la base del processo Balke in due fasi:[14]
Conversione ad alogenuriSono noti molti metodi per la conversione di ossido di niobio(V) negli alogenuri. Il problema principale è la reazione incompleta per dare gli ossialogenuri. In laboratorio la conversione può essere effettuata con cloruro di tionile:[15] L'ossido di niobio(V) reagisce con tetracloruro di carbonio (CCl4) per dare ossicloruro di niobio (NbOCl3). Conversione a niobatiIl trattamento dell'ossido di niobio(V) con idrossido di sodio (NaOH) acquoso a 200 °C può dare niobato di sodio cristallino (NaNbO3) mentre la reazione con idrossido di potassio (KOH) può produrre esaniobati solubili di tipo Lindqvist, come Nb6O198− [16]. I niobati di litio come LiNbO3 e Li3NbO4 possono essere preparati mediante reazione di carbonato di litio e ossido di niobio(V)[17][18]. Conversione in ossidi di niobio ridottiLa riduzione ad alta temperatura con idrogeno molecolare (H2) dà diossido di niobio (NbO2):[11] Il monossido di niobio deriva da una comproporzione mediante un forno ad arco:[19] L'ossido di niobio(III) di colore bordeaux, uno dei primi ossidi superconduttori, può essere nuovamente preparato mediante una comproporzione:[18] UsiIl pentossido di niobio viene utilizzato principalmente nella produzione di niobio metallico[13], ma esistono applicazioni specializzate per il niobato di litio e come componente del vetro ottico[3]. Film sottili di ossido di niobio(V) formano gli strati dielettrici nei condensatori a elettrolita solido. Note
Altri progetti
Collegamenti esterni |
||||||||||||||||||||||||||||||||||||||||||||||||












