|
Syndrome de Guillain-BarréSyndrome de Guillain-Barré
Le syndrome de Guillain-Barré (SGB) ou de Guillain-Barré-Strohl est une maladie auto-immune inflammatoire aiguë du système nerveux périphérique. Elle se manifeste brutalement par une faiblesse musculaire qui prédomine dans les régions proximales des membres, pouvant s'accroître jusqu’à la paralysie. Elle s'accompagne d'une absence ou réduction des réflexes (paralysie flasque), et de troubles sensitifs. Dans la plupart des cas, les personnes atteintes récupèrent en quelques mois, mais il existe des formes graves à évolution rapide. Depuis la quasi-disparition de la poliomyélite, le SGB est devenu la première cause de paralysie flasque aiguë dans le monde. De nos jours, il est considéré comme une des principales urgences en neurologie, mais tous les Services d'urgence n'ont pas la même connaissance de cette affection[1]. Le SGB est aussi connu sous les noms suivants :
Historique Plusieurs descriptions de cas au XIXe siècle pourraient correspondre à des SGB. En 1828, Chomel décrit une épidémie de polynévrites aiguës[2]. Un peu plus tard, Wardrop en 1834 et Ollivier en 1837 signalent quelques autres observations isolées[3]. En 1859, Octave Landry et Adolf Kußmaul décrivent, indépendamment l'un de l'autre, une maladie grave paralysant les jambes, les bras, le cou et les muscles respiratoires (paralysie ascendante de Landry, maladie ou syndrome de Landry)[4]. Des observations du même genre se retrouvent dans d'autres pays. En 1891, Quincke découvre la possibilité de prélever et d'analyser le liquide cérébrospinal par ponction lombaire. C'est la première approche biologique directe de ces maladies neurologiques. En 1916, dans un contexte de médecine de guerre, Georges Guillain, Jean Alexandre Barré et André Strohl présentent deux cas de paralysie généralisée transitoire observés chez des soldats, avec une anomalie caractéristique du liquide cérébrospinal : l'élévation anormale du taux de protéines contrastant avec un compte normal de cellules (une particularité à laquelle on donne le nom de « dissociation albumino-cytologique »)[5]. La même année et presque simultanément, quatre autres cas semblables sont publiés par Marie et Chatelin[6] mais seront ensuite inexpliquablement oubliés[7]. Dans les années 1930-1950, la recherche d'un virus causal spécifique ne donne rien. Dans les années 1960, la nature immunologique de la maladie est affirmée. Dans les années 1980, les premiers auto-anticorps liés à la maladie sont identifiés[8]. À l'origine, et jusqu'à la fin des années 1930, Guillain et Barré ont insisté sur l'évolution favorable de l'affection, pour en faire le deuxième critère déterminant du diagnostic[9], d'où une réputation erronée de bénignité ayant persisté pendant tout le XXe siècle[10]. Depuis le milieu du XXe siècle, l'évolution favorable n'est plus un critère de diagnostic. Après 1976, à la suite d'une série de cas liés à une vaccination contre une menace de grippe porcine aux États-Unis, les critères de diagnostic ont fait l'objet d'une normalisation internationale[11], périodiquement réévaluée. Ce qui permet, sous le terme simplifié de « syndrome de Guillain-Barré », de regrouper de nombreuses formes de paralysies extensives aiguës, anciennement ou nouvellement décrites, y compris les formes graves. ÉpidémiologieLe taux d'incidence de la maladie est d'environ 1,5 sur 100 000 personnes par an (entre 0,8 et 1,9 dans les pays occidentaux). Rare avant l'âge de cinq ans, le risque s'accroît avec l'âge et touche 3 hommes pour 2 femmes[12]. Les formes familiales sont exceptionnelles[13]. La récidive est également rarissime. L'origine du SGB n'est pas connue, mais il existe des facteurs déclenchants retrouvés de 1 à 6 semaines avant le début de la maladie. Il s'agit le plus souvent d'une infection (surtout digestive ou respiratoire), parfois d'une vaccination, d'un acte chirurgical, d'un évènement stressant[14]. Il peut survenir aussi au cours de maladies systémiques (lupus érythémateux) ou de la maladie de Hodgkin. La survenue d'un SGB au cours d'une grossesse est équivalente ou plus faible que celle en population générale[15],[16]. Cependant, au Brésil, lors de l'épidémie de Zika en 2016, une prévalence plus élevée de SGB au cours de la grossesse a été signalée[16],[17]. Facteurs infectieuxCampylobacter et Cytomégalovirus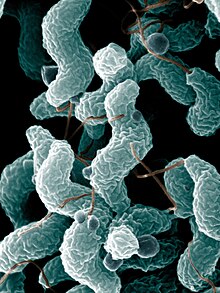 Dans 2/3 des cas, la maladie survient 1 à 3 semaines après une infection bactérienne à Campylobacter jejuni (gastroentérite et diarrhées) ou virale à Cytomégalovirus (fièvre). Le SGB survient 1 à 2 fois sur 1000 infections à cytomégalovirus, et un peu moins de 1 fois sur 1 000 infections à Campylobacter. Cette rareté pourrait s'expliquer par une susceptibilité particulière de certains individus, mais la prédisposition génétique unique est peu probable, car le SGB ne se manifeste pas au sein d'une même famille. En revanche, des petites épidémies ont été notées en Chine lors de gastro-entérites liées à la contamination de l'eau par Campylobacter jejuni[18]. Virus ZikaL'incidence du SGB associé au virus Zika est de l'ordre de 2 à 3 cas pour dix mille infections à virus Zika, risque similaire à celui associé à une infection à Campylobacter[19]. Cette complication, survenant 5 à 10 jours après l'infection, a fait invoquer d'autres processus infectieux[19], tels qu'une co-infection avec d'autres arboviroses (dengue, chikungunya...) circulant dans la même région[20]. Le SGB associé au Zika a un pronostic identique aux autres SGB, mais il se distingue cliniquement par une atteinte plus fréquente des nerfs crâniens[19]. AutresLes autres infections en cause sont celles à VIH, Epstein-Barr, Mycoplasma pneumonia, Haemophilus influenza, varicelle, etc[14]. Le premier cas de SGB associé à l'infection à SARS-CoV-2 (COVID-19) est signalé en en Chine. Quelques études suggèrent un risque accru par rapport aux patients non-COVID-19, mais l'association entre SGB et COVID-19 reste discutée en raison de la rareté du SGB et de la présence ou pas d'un confinement (lorsqu'on compare des périodes différentes)[21]. Grippe et vaccinsL’incidence du développement d'un SGB serait de 4 à 7 cas pour 100 000 sujets grippés[22]. En 1976, un risque accru de SGB est relevé après une vaccination antigrippale. La fausse alerte pandémique de 1976Début , aux États-Unis, une épidémie de grippe débute sur la base militaire de Fort Dix, dans le New Jersey, entraînant le décès d'au moins un soldat. En février, la souche virale est isolée, c'est un virus de grippe porcine H1N1 ressemblant à celui de la pandémie de 1918-1919. L'affaire est portée au plus haut niveau de l'administration américaine. Un comité d'experts, désignés à cette occasion, estime qu'une grave pandémie se prépare et suggère de produire un vaccin pour une campagne de masse dès l'automne suivant. Fin mars, le Président Gerald Ford annonce à la télévision qu'il dégage 135 millions de dollars pour un programme de vaccinations[23]. Pendant l'été 1976, 7 000 personnes sont vaccinées sans problème, ce qui permet de lancer la campagne dès la rentrée. Fin novembre, les premiers cas de SGB, survenant 2 à 3 semaines après vaccination, sont notifiés. À la mi-décembre, l'enquête épidémiologique révèle un risque accru de SGB (de 7 à 8 fois). La pandémie attendue n'ayant pas lieu, la campagne (près de 45 millions de vaccinés) est immédiatement stoppée[24]. Depuis de nombreuses études ultérieures ont confirmé la relation de causalité[25],[26]. La surveillance ultérieureL'évènement a suscité une surveillance renforcée et continue, jusqu'à nos jours, des autres vaccins antigrippaux. Durant la période 1976-2008, on trouve un léger risque accru de 1,3 à 2 cas supplémentaires pour 1 million de personnes. Lors de la vaccination antigrippale contre le H1N1 de 2009-2010, ce risque est de 1 à 6 cas par million de personnes vaccinées aux États-Unis[27], 1 à 3 ailleurs[28]. Durant la période 2010-2013, on ne retrouve pas de signal de risque accru. Cela pourrait s'expliquer par le fait qu'en 2009-2010, la population vaccinée était d'une grandeur suffisante pour détecter statistiquement une faible augmentation d'un événement rare[28]. En 2014, il est établi que le risque de SGB après une grippe (17,2 cas sur 1 million de consultations pour grippe) est bien supérieur à celui de SGB après vaccination (1,03 pour 1 million de vaccinations)[26]. Aucun lien significatif n'a été retrouvé entre SGB et d'autres vaccinations[29]. Quelques discussions ont encore lieu à propos du ROR, du HPV, et du vaccin conjugué tétravalent contre le méningocoque, mais le risque de SGB (inférieur à 1 cas par million de vaccinés) n'est pas une raison de limiter ces vaccins, car leurs avantages surpassent de beaucoup ce risque[21],[30]. En 2021, dans la campagne de vaccination contre la COVID-19, la Food and Drug Administration (FDA) signale un risque accru de Syndrome de Guillain-Barré avec le vaccin Janssen de la compagnie Johnson & Johnson[31]. En 2023, une méta-analyse évalue le risque après vaccination contre la COVID à 8,1 cas par million de vaccinations[32]. Physiopathologie Les nerfs du patient sont attaqués par son propre système immunitaire (auto-immunité). Par exemple, certaines structures de la membrane externe de la bactérie Campylobacter jejuni peuvent ressembler à des structures présentes sur les nerfs : c'est le mimétisme moléculaire. En se défendant contre la bactérie, l'organisme attaque ses propres nerfs périphériques par des auto-anticorps (anticorps dirigés contre le soi). Si l'on assimile une fibre nerveuse à un câble électrique, l'attaque peut se porter sur la gaine (en l'occurrence la gaine de myéline), c'est la forme la plus fréquente des pays occidentaux[33]. Plus rarement l'axone (le « fil conducteur ») est lui-même atteint, cette forme étant plus fréquente en Asie[13]. Selon les cas, la conduction nerveuse est ralentie, modifiée, voire interrompue. Les SGB sont ainsi divisés en plusieurs sous-types, selon les structures moléculaires ciblées, et la localisation des lésions[34]. Signes et symptômesLe syndrome se manifeste de manière sporadique (apparemment par hasard, de façon isolée). Il est imprévisible, pouvant survenir en pleine santé. Une analyse minutieuse des maladies ayant précédé dévoile souvent une post-infection ou une intervention (voir ci-dessus : grippe, gastro-entérite, zika, chikungunya, dengue, certains vaccins, ...). Le début se caractérise le plus souvent par une faiblesse générale, voire une paralysie des extrémités inférieures. Il existe, en second plan, des troubles sensitifs à type d'hypoesthésie (baisse du sens du toucher) en « gants » et en « chaussettes », engourdissements, fourmillements ou douleurs. Les réflexes ostéotendineux sont diminués ou abolis. Des crampes dans les jambes doivent alerter. La maladie comporte trois phases d'évolution :
Une paralysie aiguë du nerf facial, parfois bilatérale, peut survenir dans la moitié des cas. Une atteinte transitoire du système nerveux central se voit dans un tiers des cas, caractérisée par des hallucinations, une psychose aiguë ou des troubles du sommeil, en règle régressive[35]. Plus rarement, des formes atypiques peuvent survenir, comme l'apparition de douleurs dans la ceinture lombaire se propageant assez vite dans les fesses puis les jambes, faisant croire à une sciatique touchant simultanément les deux membres inférieurs. L'usage des jambes devient vite incontrôlé et conduit à une paralysie plus ou moins totale des membres inférieurs. Ce tableau « descendant » peut se limiter à une atteinte de ces seuls membres inférieurs[36]. Dans la majorité des cas (80 %), les personnes atteintes récupèrent leurs capacités physiques (voire séquelles légères) au bout de 6 à 12 mois. Pour les 20 % restants, 5 % d'entre eux ont des séquelles lourdes et définitives (lorsque l'axone est touché) la motricité se retrouve altérée (on parle de maladie neuromusculaire). Un taux de mortalité est constaté entre 10 et 15 % (service de réanimation). Les douleurs précèdent les paralysies dans un tiers des cas et peuvent persister au-delà de l'amélioration des déficits, après plus d'un an d'évolution[37]. Une fatigue peut, de même, persister après guérison de l'atteinte motrice, quel que soit le niveau d'atteinte initial[38]. DiagnosticLe diagnostic est principalement clinique, basé sur la répétition de l'examen neurologique montrant l'allure extensive ascendante, la faiblesse motrice symétrique, la diminution des réflexes. Le diagnostic est confirmé par la ponction lombaire qui peut montrer, à partir de la 2e semaine, une augmentation de la concentration en protides dans le liquide cérébrospinal avec un compte normal de cellules du liquide cérébrospinal (dissociation albumino-cytologique). C'est l'élément de diagnostic le plus discriminant, mais il ne permet pas un pronostic (son constat, précoce ou tardif, ne permet pas de préjuger la gravité de la maladie). L'électromyographie consiste en la mesure de la vitesse de conduction nerveuse (VCN-EMG). Elle met en évidence un ralentissement ou une absence de conduction nerveuse dans près de 85 % des cas[33]. L'examen révèle s'il y a atteinte de l'axone des nerfs périphériques dans les cas les plus graves de SGB. La répétition de cet examen permet de préciser le sous-type de SGB en donnant des éléments de pronostic. Le diagnostic différentiel doit éliminer d'autres causes de neuropathie périphérique (dans les cas où le SGB se présente d'abord de façon incomplète ou atypique). En premier lieu les causes mécaniques (compression médullaire), puis inhalation d'un solvant organique, absorption de plomb ou de certains médicaments, tels que la nitrofurantoïne ou la dapsone), les causes infectieuses (diphtérie, poliomyélite, botulisme), les causes métaboliques (porphyrie intermittente aiguë, hypokaliémie). ComplicationsLa gravité de la pathologie peut varier considérablement d'un cas moyen pouvant même ne pas être porté à la connaissance d'un médecin, à celui d'une maladie dévastatrice liée à une paralysie presque totale plaçant le patient entre la vie et la mort. Il existe quatre principales complications du SGB qui justifient que le patient soit dans certains cas hospitalisés dans une unité de réanimation :
Il existe également des complications ne mettant pas en jeu le pronostic vital du patient mais occasionnant une gêne importante, ce sont les rétractions tendineuses dues à l'absence de mouvements, elles peuvent être prévenues grâce à la kinésithérapie ; les douleurs doivent être prises en charge par des antalgiques spécifiques. Formes cliniquesPlusieurs formes se distinguent selon l'étude électromyographique. La forme habituelle est myélinique (démyélinisante) et guérit le plus souvent en quelques semaines sans séquelle. La forme axonale (c'est-dire par lésion de l'axone) est plus rare mais aussi plus sévère et peut laisser des séquelles à long terme, en touchant soit uniquement les nerfs moteurs, soit les nerfs moteurs et sensitifs. On parle alors de forme AMAN (Acute Motor Axonal Neuropathy) Syndrome de Miller-FisherLe syndrome de Miller-Fisher, ou syndrome de Fisher, ou SMF, est une variante du syndrome de Guillain-Barré, caractérisée par :
Il a été décrit en 1955 pour la première fois[39]. L'évolution est, en règle générale, favorable et sans séquelle[40]. Autres formes
TraitementLa prise en charge dans un centre de soins aigus est souhaitable, avec selon les cas, une convalescence dans un centre de rééducation, et un suivi par un programme de rééducation hors-hôpital ou en hôpital de jour. Les plasmaphérèsesProposées dès 1978, les plasmaphérèses (échanges ou soustractions plasmatiques) ont été utilisées dans des formes graves et modérées du syndrome de Guillain-Barré avec une efficacité démontrée sur la vitesse de récupération et le risque de séquelles[41]. La réalisation d'une circulation extra-corporelle nécessite un personnel spécialisé et des précautions d'asepsie très rigoureuses. Les gammaglobulinesEn 1988 et 1989, quelques chercheurs ont rapporté les effets bénéfiques de doses élevées de gammaglobulines (ou immunoglobulines) dans le traitement de la maladie. Ce traitement serait au moins aussi efficace que la plasmaphérèse, tout en étant plus simple d'administration (absence de nécessité d'un équipement spécialisé et de personnel qualifié)[42],[43]. Cette prise en charge thérapeutique (immunothérapie) est généralement employée, elle permet un rétablissement le plus souvent sans séquelles[44]. Autres traitementsLa cortisone n'a pas démontré d'efficacité[13], même sur les douleurs[45]. La plupart des autres traitements ont pour but de prévenir ou de traiter les complications du syndrome : embolie pulmonaire (anticoagulants, bas de contention[46]). La lutte contre la constipation et l'infection urinaire secondaire à une rétention et à l'alitement prolongé doit être mise en œuvre. Les douleurs peuvent nécessiter l'emploi de médicaments morphiniques. L'indication de la mise sous respirateur artificiel dépend de la gravité de l'atteinte, la décision pouvant être aidée par l'objectivation d'une forte diminution de la capacité vitale mesurée lors d'épreuves fonctionnelles respiratoires[47]. Un traitement antibiotique ou antiviral ciblé sur le germe suspecté comme responsable est inutile, ce dernier ayant, en règle générale, disparu de l'organisme lorsque les premiers symptômes apparaissent. Dans tous les cas, l'immobilisation entraîne un risque de phlébite des membres inférieurs qui doit être prévenu par l'administration d'héparine ou d'une contention élastique. Des séances de kinésithérapie sont également recommandées et administrées. RééducationÀ la suite de la phase aiguë, environ 40% de personnes ont besoin d'une rééducation intensive avec le concours d'une équipe multidisciplinaire ciblée vers l'amélioration de la qualité de vie quotidienne (AQVQ)[48]. Les études sur le sujet sont limitées mais il est probable que la rééducation intensive améliore les symptômes à long terme[49]. Les équipes doivent inclure des kinésithérapeutes, des ergothérapeuthes, des orthophonistes, des travailleurs sociaux, des psychologues et d'autres aides-soignants et infirmiers. L'équipe est habituellement sous la supervision d'un médecin neurologue ou d'un médecin spécialisé en rééducation qui dirige le traitement et ses objectifs[48],[50]. Les interventions de kinésithérapie comportent la musculation, l'endurance et entraînement de la démarche avec augmentation progressive de la mobilité, de la posture et de l'alignement comme des fonctions conjointes. Le traitement commence par une séance de balnéothérapie[51]. L'ergothérapie a pour objectif d'améliorer les fonctions de la vie de tous les jours comme les tâches domestiques et les tâches communes aussi bien dans la conduite automobile que dans le travail. Des modifications de l'habitat, des aides aux démarches, de l'orthopédie et des attelles pourront être fournis[48]. Un traitement des troubles du langage peuvent être nécessaires, aussi bien pour aider à la communication que pour une aide à la respiration (souvent par une trachéotomie). Une aide à la nutrition peut être fournie par l'équipe et un diététicien. Un psychologue peut fournir conseil et aide. Ses interventions peuvent aussi être nécessaires pour l'anxiété, la peur et la dépression[48]. PronosticL'évolution est difficile à prévoir. Les éléments de mauvais pronostic sont :
Le quart des patients requiert une ventilation assistée en raison de la faiblesse des muscles respiratoires[53]. En l'absence de soins appropriés lors de l'atteinte, le décès peut être très rapide, mais pas nécessairement attribué au SGB. La mortalité est d'un peu moins de 10 %[53]. Elle est essentiellement secondaire à des troubles du rythme cardiaque, une infection ou à une embolie pulmonaire[54]. Elle atteint 20 %[55] pour les formes sévères (troubles de la déglutition et paralysie des muscles respiratoires nécessitant une ventilation mécanique). Il existe un risque de séquelles à long terme : de 5 à 15 % des patients demeureront invalides à plus ou moins long terme. 35 % environ se plaignent d'anomalies légères à long terme comme des étourdissements. La récidive est rare mais possible[56]. Malades célèbresOn pense aujourd'hui que c'est de séquelles de cette maladie que souffrait le président américain Franklin D. Roosevelt, paralysé des jambes à partir des années 1920, et non de la poliomyélite, comme avancé à l'époque[57],[58]. Autres personnalités :
Associations de patientsCette maladie orpheline est mal connue du grand public comme d'une proportion inquiètante de médecins régulateurs du SAMU. Ce dernier point est un des facteurs de la mauvaise prise en charge des patients et de leur mauvaise orientation vers les services de neurologie pourtant très compétents. Des associations de patients pratiquent l'accueil téléphonique des familles et l'assistance morale. Dans les cas les plus graves, les associations peuvent fournir l'aide d'avocats spécialisés.
Témoignages et romans
Notes et références
Voir aussiArticles connexesLiens externes
|