|
CytomégalovirusCytomegalovirus Cytomegalovirus
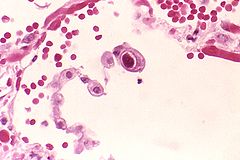
Inclusion cellulaire pulmonaire à CMV.
Le cytomégalovirus (CMV) Cytomegalovirus humanbeta5, aussi appelé Herpèsvirus humain de type 5 (HHV-5), est un virus responsable d'infections passant le plus souvent inaperçues. Son caractère pathogène survient surtout chez des patients dont les défenses immunitaires ont été affaiblies, tels ceux traités par immunosuppresseurs, atteints par le sida, et les fœtus. Le CMV rend aussi vulnérables les patients déjà atteints d'une maladie systémique, cette dernière pouvant provoquer une immunodépression. Une infection à cytomégalovirus chez la femme enceinte peut provoquer des lésions chez le fœtus. Il s'agit de l'infection fœtale congénitale la plus fréquente dans les pays industrialisés. Le Cytomegalovirus humanbeta5 est présent à vie dans 30 à 70 % de la population. Chez des personnes prédisposées, il peut causer l’apparition d'un glioblastome (cancer du cerveau). Il n'existe pas encore de vaccin[2]. Le virus Le cytomégalovirus appartient à la famille des herpèsvirus qui comprend 8 espèces infectieuses chez l'homme, dont les plus connues sont le virus d'Epstein-Barr, le virus varicelle-zona et le cytomégalovirus lui-même. Cette famille de virus est caractérisée par sa capacité à produire des infections latentes et persistantes. Sa structure comporte un génome, une capside, une enveloppe recouverte de glycoprotéines. Le génome (ADN double brin linéaire) est emballé dans une structure protéique appelée capside, qui a une conformation géométrique polyédrique (icosaédrique). Liste des espèces[3]
ÉpidémiologieL'être humain est le seul réservoir de ce virus et sa transmission se fait par contact car c'est un virus très fragile. Ce virus se transmet par toutes les sécrétions corporelles : salive, sang, sperme, larmes, lait maternel, sécrétions du vagin et du col de l'utérus. Cette infection a une répartition mondiale sans rythme saisonnier. La prévalence est de 30 à 70 % dans les pays d’Europe de l'Ouest et d’Amérique du Nord, et de 80 à 100 % dans les pays en voie de développement. Sensibilités et viabilitéL'antiviral Ganciclovir réduit ou interrompt la réplication virale in vivo. Cent fois plus actif que l'Aciclovir, il est également beaucoup plus toxique (toxicité médullaire : neutropénie et thrombopénie) et n'est utilisé que dans le traitement des infections sévères chez les immunodéprimés. Le CMV est sensible aux désinfectants (hypochlorite de sodium à 1 %, éthanol à 70 %, glutaraldéhyde, formaldéhyde). Le CMV est sensible à la chaleur (50 à 60 °C pendant au moins 30 minutes), à des solvants lipidiques, un faible pH, aux rayons ultraviolets, aux cycles de congélation et de décongélation, ce qui l'inactive. Le CMV peut survivre pendant quelques jours à température ambiante à l'extérieur de son hôte. Cytomégalovirus et grossesseParmi les pathologies infectieuses survenant en cours de grossesse pouvant entrainer une atteinte fœtale, celle à cytomégalovirus (CMV) revêt un caractère particulier aujourd’hui pour deux raisons : l’atteinte auditive peut survenir de façon décalée par rapport à la naissance et dans les quatre premières années de vie et le traitement antiviral s’il est administré dès la naissance et/ou chez la mère avant la 12e semaine de grossesse permet de réduire le risque d’apparition de séquelles neurosensorielles[4]. CliniqueL’infection à CMV se distingue des autres infections au cours de la grossesse par sa fréquence puisqu’elle concerne 0,4 % des naissances en France, et par sa gravité, puisque c'est la première cause de retard mental alors qu’au seul niveau de l’oreille, elle est responsable de 1 surdité sur 2 000 naissances, représentant largement la première cause de surdité non génétique[5],[6],[4]. En cas d’infection maternelle, il s’agit une fois sur deux d’une primoinfection avec séroconversion au cours des 3 mois précédant ou suivant la conception. Il s’agit d’une infection secondaire avec réactivation virale ou contact avec un nouveau sérotype. Le virus se transmet au fœtus dans 50 % des cas.
80 % des femmes enceintes seront asymptomatiques, les autres 20 % présenteront un syndrome pseudogrippal ou seront simplement fébriles. L’immunisation préalable de la mère ne confère donc pas une protection efficace. Le CMV est extrêmement présent dans les crèches, où 80 % des enfants excrètent le virus. Chez la femme enceinte non immunisée, le risque de contamination est augmenté par le fait d'avoir un enfant en bas âge, surtout s'il va en crèche. La contamination se fait alors surtout lors des changements de couches ou du partage des couverts. Conséquence d'une infection maternelle chez le fœtusParticularité de la surdité par infection à CMVLa fréquence de la transmission materno-fœtale est de l’ordre de 35 % aux trois trimestres de la grossesse mais, fait fondamental, le risque d’atteinte neurosensorielle chute considérablement de 40 % au premier trimestre pour pratiquement disparaître après la 12e semaine de grossesse[4]. La surdité prend tous les visages car elle peut survenir de façon décalée par rapport à la naissance avec un délai d’apparition de 16 à 20 mois et/ou s’aggraver progressivement tout au long de la vie. Finalement, elle touchera environ 13 % des enfants infectés, soit 33 % des enfants symptomatiques et 10 % des enfants asymptomatiques ; elle sera responsable finalement de 25 % des surdités des enfants de 4 ans[7]. Le risque de surdité est identique que l’on soit en situation de primoinfection ou de récurrence. Outre la prématurité, il est surtout corrélé à l’importance de la charge virale à la naissance et à une excrétion virale urinaire forte et prolongée : le risque de surdité chez l’enfant asymptomatique croît linéairement entre 3 000 et 30 000 copies/ml avec un risque élevé de séquelles tardives lorsque la charge initiale dépasse les 12 000 copies/ml[8]. Lorsque la surdité survient, elle est surtout sévère à profonde, bilatérale dans 43 % des cas chez le nouveau-né asymptomatique et dans 70 % des cas chez le nouveau-né symptomatique. L’enfant atteint secrétera du virus dans la salive et dans les larmes pendant au moins 1 an, dans les urines pendant au moins 2 ans[7]. La certitude de la responsabilité du CMV dans la genèse de la surdité n’est possible qu’au cours des 3 premières semaines de vie en recherchant sa présence dans la salive, le sang et les urines car au-delà, il peut s’agir d’une infection néonatale dont le pronostic est radicalement différent. Au-delà de 3 semaines et jusqu’à 2 ans, chez un enfant atteint de surdité avec présence de CMV dans la salive et les urines, un diagnostic rétrospectif peut être envisagé secondairement en utilisant la PCR sur le carton de Guthrie en sachant qu’il n’est conservé que de 2 à 8 ans selon les régions, que la sensibilité du test n’est pas de 100 % et qu’il n’est pas simple d’y avoir accès[4]. Autres atteintesLes atteintes caractéristiques du CMV au niveau du fœtus sont :
Le diagnostic est généralement évoqué à l'échographie. Le pronostic est fonction de l'atteinte neurologique. DiagnosticSignes échographiques
À la naissanceÀ la naissance, les nouveau-nés infectés in utero au cours du premier trimestre sont cliniquement symptomatiques dans 30 % des cas, 10 à 15 % d'entre eux développeront des séquelles cognitives et motrices potentiellement sévères[9],[10]. Dans 70 % des cas, ces nouveau-nés sont totalement asymptomatiques à l’exception d’un déficit auditif chez 15 à 30 % d’entre eux, le plus souvent unilatéral mais potentiellement évolutif et qui ne serait accessible que par un dépistage systématique à la naissance pour l’heure inexistant ou presque. Méthode indirecte
Méthode directeCette méthode nécessite de recueillir du liquide amniotique au cours d'une amniocentèse.
TraitementIl n'existe aucun traitement disponible pour diminuer le risque d'atteinte fœtale. Lorsque le diagnostic d'infection fœtale à CMV est posé sur des critères échographiques et recherche de cytomégalovirus par PCR, il est possible de pratiquer une interruption médicale de grossesse. On dispose de deux médicaments antiviraux la DHPG (Ganciclovir) et l'acide phosphonoformique (Foscarnet). Un troisième médicament, l'HPMPC (Cidofovir), est réservé en cas de résistance aux deux précédents. Il n'y a pas de vaccin actuellement au point contre le CMV. Les gammaglobulines à haut titre d'anticorps anti-CMV ont, en injections répétées, une activité préventive (greffes). Prévention
Dépistage de l'infection à CMV chez la femme enceinteLe Collège national des gynécologues et obstétriciens français considère qu’en l’état actuel des connaissances, une politique de dépistage systématique du CMV au cours de la grossesse n’est pas justifiée par des bénéfices démontrés et qu’elle aurait sans doute des conséquences néfastes[11]. Hormis la Belgique et l'Italie, aucun pays ne pratique le dépistage systématique de l'infection à CMV chez la femme enceinte car :
Seules les mesures d'hygiène permettent actuellement de réduire l'incidence des infections congénitales à CMV. En BelgiqueEn Belgique, le Conseil supérieur de la santé émet une opinion d'expert faisant le point sur la problématique dans le pays pour les femmes enceintes[12]. Les principales recommandations de l'avis sont :
Tropisme cellulaireCellules ciblesSites de latences
Clinique
Cytomégalovirus et SIDAAu stade SIDA du VIH, on a un taux de CD4 très bas avec donc une immunité cellulaire minime. Que ce soit en primoinfection, en récurrence ou en réactivation, les symptômes sont plus sévères que chez le sujet immunocompétent :
On ne retrouve aucune de ces symptomatologies chez l'immunocompétent. Cytomégalovirus et personnes sous immunodépresseursLa prise en charge de cette infection virale chez le transplanté a fait l'objet de la publication de recommandations internationales datant de 2018[16]. Le cytomégalovirus est particulièrement répandu chez les transplantés rénaux. En règle générale, il se manifeste peu de temps après la greffe (2 à 3 semaines) et se diagnostique sur la courbe de température du malade qui est assez caractéristique : température normale le matin, puis montée en flèche dans la mi-journée à plus de 39 °C, 40 °C pour redescendre et se stabiliser la nuit et ainsi de suite… La durée peut être variable selon l'état général du patient mais elle avoisine les trois semaines, au cours desquelles, étant donné le fort taux d'immunodépresseur lié à la greffe, aucun traitement ne sera prescrit. Lorsqu'il est sûr que c'est bien un CMV, le traitement consiste à boire régulièrement beaucoup d'eau, éventuellement le médecin prescrira une dose moindre d'immunodépresseur (selon les cas) et la surveillance doit se faire en milieu hospitalier jusqu'à ce que la pointe de température du midi commence à présenter une courbe descendante pour finir par se stabiliser à une température « normale ». Une infection à CMV reste cependant associée à un plus grand risque de diabète, d'infections opportunistes et de rejet du greffon[17]. TraitementLe ganciclovir (Cymevan) et sa prodrogue estérifiée, le valganciclovir (Rovalcyte), sont des analogues de désoxyguanosines efficaces contre le cytomégalovirus. Cependant, outre le fait qu'ils sont toxiques pour la moelle osseuse, ils sont mutagènes et tératogènes, et sont de ce fait contre-indiqués en cas de grossesse. Le valganciclovir a l'avantage de pouvoir être donné par voie orale, ce qui est plus pratique en cas de traitement prolongé[18]. On peut administrer à la place du foscarnet (foscavir), un analogue de pyrophosphate, ou du cidofovir (Vistide), un analogue de la cytidine, actif après une double phosphorylation. Cependant, ces deux molécules ont une certaine toxicité rénale. Ces trois molécules sont des inhibiteurs de l'ADN polymérase virale. Le letermovir cible la sous-unité pUL56 de la terminase virale et semble être prometteur en traitement préventif[19]. Articles connexes
Notes et références
Référence biologique
Bibliographie
Liens externes
|