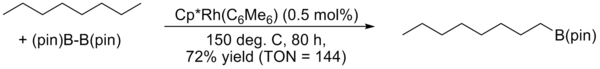|
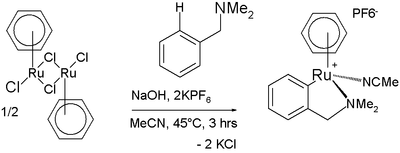
Activation de liaison C-HL'activation de liaison carbone-hydrogène, ou activation C-H, est une réaction qui rompt une liaison carbone-hydrogène[1],[2],[3],[4],[5],[6],[7],[8],[9],[10]. L'expression se limite le plus souvent à la désignation de réaction mettant en jeu des complexes organométalliques et qui procèdent par la coordination d'un hydrocarbure à la sphère interne du métal, soit par un intermédiaire "alcane ou aryle complexe" soit comme un état de transition menant à un intermédiaire "M-C" [11],[12],[13]. Cette définition inclut aussi le fait que, lors de la rupture de la liaison C-H, l'espèce hydrocarbure reste associée à la sphère interne et sous l'influence du métal. Les études théoriques aussi bien que les investigations expérimentales indiquent que la liaison C-H, usuellement considérée comme non réactive, peut être rompue par coordination. De nombreux efforts ont été effectués pour le design et la synthèse de nouveaux réactifs et catalyseurs dans ce domaine. Un des principaux intérêts au développement de cette recherche, est l'idée que l'activation C-H pourrait permettre la conversion d'alcanes peu onéreux et disponibles en grandes quantités en des composés fonctionnalisés de plus haute valeur ajoutée. HistoriqueLa première réaction d'activation C-H est souvent attribuée à Otto Dimroth qui, en 1902, rapporta la réaction du benzène avec l'acétate de mercure(II) mais certains académiques ne considèrent pas cette réaction comme étant réellement de l'activation C-H. Comme l'ont observé Goldman & Goldberg[11], l'activation C-H a certains aspects de l'activation H-H, puisque les deux peuvent être effectuées par oxydation électrophile ou nucléophile. La première véritable activation C-H a été rapportée par Joseph Chatt[14] en 1965 avec l'insertion d'un atome de ruthénium, ligandé par du dmpe, dans une liaison C-H du naphtalène. En 1969, A.E. Shilov a publié l'échange isotopique entre du méthane et de l'eau lourde en présence de tetrachloroplatinate de potassium. Le mécanisme proposé faisait intervenir une liaison méthane-Pt(II). En 1972, le groupe de Shilov a pu produire du méthanol et du chlorométhane à partir de méthane et d'eau, en présence de tetrachloroplatinate de potassium et d'une quantité catalytique d'hexachloroplatinate de potassium. Ces travaux furent cependant longtemps ignorés de la communauté scientifique, Shilov ayant publié sous l'ère de l'Union Soviétique, pendant la guerre froide. Ce "système" de Shilov est aujourd'hui considéré comme le premier véritable exemple de fonctionnalisation d'alcane par voie catalytique[11]. De leur côté, M.L.H. Green[15] rapporta en 1970 l'insertion de tungstène (sous forme de Cp2WH2) dans les liaisons C-H du benzène par activation photochimique et M. Whitesides[16] a été le premier en 1979 a mener une activation C-H intramoléculaire sur un composé aliphatique. L'avancée majeure suivante fut effectuée de manière indépendante par deux groupes en 1982. R.G. Bergman démontra l'activation photochimique des liaisons C-H du cyclohexane et du néopentane pour former le complexe métallique Cp*Ir(PMe3)H(C6H5)[17] tandis que W.A.G. Graham découvrit que les mêmes hydrocarbures réagissent avec Cp*Ir(CO)2 pour former un complexe d'iridium[18]. Plus tard, en 1999 et 2000, Hartwig développa la borylation régiosélective d'aryles et alcanes par un complexe de rhodium. Dans le cas des alcanes, la formation exclusive du dérivé boré terminal a été observée[19]. DéveloppementDans une étude, le pentane est sélectivement converti en le dérivé halogéné 1-iodopentane, à l'aide d'un complexe de tungstène[20]. Le complexe de tungstène est formé d'une unité Cp*, d'un groupement nitroso, d'une unité butène et d'un ligand néopentane. Ce complexe est thermodynamiquement instable et, au moment de la dissolution dans le pentane, perd son ligand néopentane et se coordonne au pentane. Ce changement de ligand s'opère via le complexe à 16 électrons possédant un ligand butadiène formé par élimination bêta. Lors d'une seconde étape, l'iode est ajoutée à −60 °C et on observe la formation de 1-iodopentane. Les liaisons C-H aromatiques peuvent aussi être activées par des complexes métalliques, malgré le fait qu'elles soient relativement peu réactives. Un exemple est le couplage d'oléfines de Murai. Dans cette réaction, un complexe de ruthénium réagit avec la N,N-diméthylbenzylamine dans un processus de cyclométallation comprenant une activation C-H. L'activation d'une liaison C-H vinylique est également envisageable, comme l'a montré Yotphan en 2008 par la synthèse d'une amine bicyclique en présence d'un complexe de rhodium[21]. Il a été également démontré par R.A. Periana et al. que les sels et complexes de certains métaux de transitions tels que Pt, Pd, Au et Hg peuvent réagir avec le méthane dans l'acide sulfurique pur former de l'acide méthylsulfurique, avec des rendements variés selon le métal, et de hautes sélectivités[22],[23].  Conditions RéactionnellesLa plupart des réactions d'activation C-H nécessitent des conditions plutôt dures (haute température, milieux fortement acides ou basiques, oxydants forts), ce qui diminue beaucoup leur attractivité. Toutefois, de plus en plus de réactions aux conditions douces ont été développées, étendant significativement le champ d'application de ces transformations[24]. L'organocatalyse a été récemment utilisée comme approche sans métal et peu onéreuse[25]. Récemment, Hashigushi et al. ont découvert que les hydroxydes métalliques et les aqua-complexes pouvaient être utilisés pour mener des réactions d'activation C-H sur des substrats solubles dans l'eau sous conditions fortement basiques[26]. Ils ont notamment montré qu'un précatalyseur au ruthénium avec une pince NNN (2,6-diimidizopyridine, IPI), une fois dissout en milieu aqueux basique, générait le complexe mixte correspondant, Ru(IPI(OH)n(H2O)m). Ce complexe s'est ensuite montré capable de catalyser l'échange H/D entre l'aryle et la base, avec un accroissement de la concentration en KOH en fonction de la réduction du Ru(III) en Ru(II). Ce fut la première démonstration d'une activation C-H accélérée par une base.  Voir aussiRéférences
|
Portal di Ensiklopedia Dunia