|
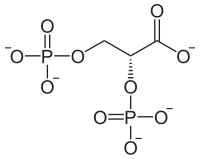
Acide 2,3-bisphosphoglycérique
L’acide 2,3-bisphosphoglycérique — ou 2,3-bisphosphoglycérate sous forme déprotonée, abrégée en 2,3-BPG — est un composé organique, isomère de l'acide 1,3-bisphosphoglycérique, un important intermédiaire métabolique de la glycolyse. Il intervient, chez l'espèce humaine, dans la régulation du transport du dioxygène dans le sang, en stabilisant la forme désoxy de l'hémoglobine. Cette stabilisation diminue l'affinité de l'hémoglobine pour le dioxygène, permettant sa libération à proximité des tissus cibles. Il se forme à partir du 1,3-bisphospho-D-glycérate (1,3-BPG) sous l'action de la bisphosphoglycérate mutase, une enzyme spécifique aux érythrocytes et aux cellules du placenta :
Il est ensuite converti en 3-phospho-D-glycérate (3PG) par la bisphosphoglycérate phosphatase :
Il s'agit d'une voie détournée de la glycolyse, court-circuitant l'étape catalysée par la 3-phosphoglycérate kinase. Le 2,3-BPG agit en augmentant la stabilité de la forme désoxy de l'hémoglobine, induisant par conséquent le passage de la forme oxy à la forme désoxy avec libération du dioxygène[2]. Il possède effectivement une action hétérotrope négative, c'est-à-dire que le 2,3-BPG inhibe la fixation du dioxygène. Le 2,3-BPG constitue un effecteur allostérique de l'hémoglobine. C'est donc un régulateur du transport d'oxygène dans le sang, qui rend ce dernier globalement plus efficace et intervient en particulier dans l'adaptation aux altitudes élevées, caractérisées par une pression atmosphérique inférieure, impliquant une pression inspirée en oxygène inférieur à celle du niveau de la mer. Un taux élevé est également retrouvé en cas d'insuffisance cardiaque[3]. L'augmentation du taux de 2,3-BPG est secondaire à l'activation de l'AMPK érythrocytaire, cette dernière induisant une phosphorylation de la bisphosphoglycérate mutase entraînant une production accrue de 2,3-BPG[4]. Notes et références
Voir aussiLiens externes
|
||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia