|
Óxido de estaño(II)
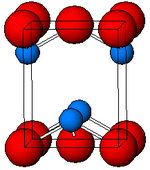
El óxido de estaño(II), (óxido estañoso) es un compuesto de fórmula SnO. Está compuesto por estaño y oxígeno, donde el estaño tiene el estado de oxidación +2. Se presenta en dos formas, una estable de color negro azulado y otra metaestable de color rojo. Preparación y reacciones El SnO negro azulado se puede producir calentando el hidrato de óxido de estaño (II), SnO·xH2O (x<1) precipitado cuando una sal de estaño (II) reacciona con un hidróxido alcalino como el NaOH.[2] El SnO rojo metaestable puede prepararse calentando suavemente el precipitado producido por la acción del amoníaco acuoso sobre una sal de estaño(II).[2] El SnO puede prepararse como sustancia pura en el laboratorio, mediante el calentamiento controlado de oxalato de estaño(II) (oxalato estañoso) en ausencia de aire o bajo una atmósfera de CO2. Este método también se aplica a la producción de óxido ferroso y óxido manganoso.[3][4] SnC2O4·2H2O → SnO + CO2 + CO + 2 H2O El óxido de estaño(II) arde en el aire con una llama verde tenue para formar SnO2.[2] 2 SnO + O2 → 2 SnO2 Cuando se calienta en una atmósfera inerte, se produce una dismutación inicial que da Sn metálico y Sn3O4, que a su vez reacciona para dar SnO2 y Sn metálico.[2] 4SnO → Sn3O4 + Sn Sn3O4 → 2SnO2 + Sn El SnO es anfótero, se disuelve en ácido fuerte para dar sales de estaño(II) y en base fuerte para dar estannitas que contienen Sn(OH)3-.[2] Puede disolverse en soluciones ácidas fuertes para dar los complejos iónicos Sn(OH2)32+ y Sn(OH)(OH2)2+,[2] y en soluciones menos ácidas para dar Sn3(OH)42+.[2]Obsérvese que también se conocen las estannitas anhidras, por ejemplo K2Sn2O3, K2SnO2. [5][6][7] El SnO es un agente reductor y se cree que reduce el cobre(I) a grupos metálicos en la fabricación del llamado "vidrio rubí de cobre". [8] EstructuraEl α-SnO negro adopta la estructura de capa tetragonal PbO que contiene cuatro átomos de estaño piramidales cuadrados coordinados.[9] Esta forma se encuentra en la naturaleza como el raro mineral romarchita. [10] La asimetría se suele atribuir simplemente a un par solitario estéricamente activo; sin embargo, los cálculos de densidad electrónica muestran que la asimetría está causada por una interacción antienlazante de los orbitales Sn(5s) y O(2p).[11] La estructura electrónica y la química del par solitario determinan la mayoría de las propiedades del material.[12] Se ha observado no estequiometría en el SnO.[13] La brecha de banda electrónica se ha medido entre 2,5eV y 3eV.[14] UsosEl óxido de estaño se utiliza principalmente como precursor en la fabricación de otros compuestos o sales de estaño, normalmente divalentes. El óxido estañoso también puede emplearse como agente reductor y en la creación de vidrio rubí.[15]Tiene un uso menor como catalizador de esterificación. El óxido de cerio (III) en forma cerámica, junto con el óxido de estaño (II) (SnO), se utiliza para la iluminación con luz ultravioleta.[16] Referencias
Enlaces externos
|
||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia