|
Willgerodt-ReaktionDie Willgerodt-Reaktion ist eine Namensreaktion der Organischen Chemie, die von dem deutschen Chemiker Conrad Willgerodt (1841–1930) entwickelt wurde.[1][2] 1923 verbesserte Karl Kindler (1891–1967)[3] das Verfahren,[4] und so wurde die Reaktion als Willgerodt-Kindler-Reaktion bekannt. ÜbersichtsreaktionDie Willgerodt-Reaktion beschreibt die Synthese einer Carbonsäure aus einem Alkylarylketon. Im einfachsten Fall wird Acetophenon zu Phenylessigsäure oxidiert: 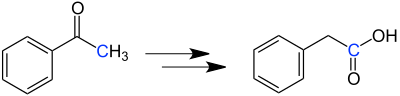 In der Willgerodt-Reaktion wird wässrige Ammoniumpolysulfid-Lösung als Oxidationsmittel benutzt; im Allgemeinen wird unter Druck gearbeitet.[5] Dabei bleibt die Anzahl der Kohlenstoffatome unverändert. Die Carbonylgruppe des Reaktionsproduktes ist stets am Ende der Akylkette positioniert. Beispielsweise entsteht aus dem Phenylethylketon Ph–CO–CH2–CH3 die Carbonsäure Ph–CH2–CH2–COOH. Analog bildet sich aus Phenylketon Ph–CO–CH2–CH2–CH3 die Carbonsäure Ph–CH2–CH2–CH2–COOH.[6] Bei der von Kindler beschriebenen Variante (Willgerodt-Kindler-Reaktion) wird statt der Ammoniumpolysulfid-Lösung ein Gemisch aus elementarem Schwefel und einem sekundären Amin eingesetzt.[7] Das sekundäre Amin kann auch durch ein primäres Amin oder durch Ammoniak ersetzt werden.[6] Durch Kindlers Verbesserung des Verfahrens kann drucklos gearbeitet werden. Carbonsäure-Derivate als ReaktionsprodukteJe nach Reaktionsführung kann man statt der Carbonsäuren auch Carbonsäureamide (X = O, Willgerodt-Reaktion) oder Carbonsäurethioamide (X = S, Willgerodt-Kindler-Reaktion) herstellen:[8]  Der Rest R am Stickstoffatom steht meist für eine Organylgruppe (z. B. Alkylgruppe). MechanismusDer Mechanismus der Reaktion ist noch nicht vollständig bekannt.[9] Da die Willgerodt-Kindler-Reaktion nur eine Modifikation der Willgerodt-Reaktion ist, lassen sich beide Methoden mit dem gleichen Mechanismus beschreiben. Dieser soll am Beispiel der Phenylessigsäure (5) aus Acetophenon (1) diskutiert werden: Zuerst reagiert das Keton 1 mit einem sekundären Amin zu einem Enamin 2. Durch einen elektrophilen Angriff seitens des Schwefels lagert sich der Schwefel am Enamin an. Nach mehreren Umlagerungen von Elektronenpaarbindungen sowie intramolekularen Wanderungen der sauren Wasserstoffatome entsteht ein Thioamid 3, das über das Säureamid 4 zur Carbonsäure 5 hydrolysiert.[5][9]  Dieser Mechanismus erklärt aber nur den möglichen Verlauf der Reaktion im Falle von Arylmethylketonen. Die Bildung von endständigen Carbonsäuren aus Ketonen mit höheren Alkylgruppen lässt sich so nicht erklären. Ähnliche ReaktionenBei der Dreikomponentenreaktion von primären Aminen, aromatischen Aldehyden und Schwefel bilden sich Thioamide von aromatischen Carbonsäuren.[10] Einzelnachweise
|
Portal di Ensiklopedia Dunia