|
Mushroom Spring
Koordinaten: 44° 32′ 19,3″ N, 110° 47′ 52,8″ W Mushroom Spring (oder Mushroom Pool) ist die Bezeichnung einer heißen Quelle im unteren Geysir-Becken des Yellowstone-Nationalparks.[1][2] Die Quelle befindet sich in der Nähe der großen Geysire Great-Fountain-Geysir und White-Dome-Geysir.[4] Die Temperatur des Quellwassers, wenn es aus der Tiefe an die Oberfläche kommt, beträgt 69° C und nimmt am Abfluss ab.[3] Licht ist die wichtigste Energiequelle für die phototrophe mikrobielle Matte im Mushroom Spring. Obwohl sie oft einfach als eine „Cyanobakterienmatte“ bezeichnet wird, leben in der Matte ganz unterschiedliche phototrophe Bakterien, neben Cyanobakterien auch Grüne Nichtschwefelbakterien und Grüne Schwefelbakterien.[3] MikroökologieDie Erforschung biologischer Organismen in heißen Quellen begann in den 1960er Jahren. Anfangs dachte man, dass thermophile Bakterien (und Archaeen, diese wurden damals noch nicht von den Bakterien unterschieden) bei Temperaturen von über 55 °C nicht überleben könnten. Man entdeckte jedoch bald, dass viele Bakterien in verschiedenen dieser heißen Quellen selbst bei höheren Temperaturen nicht nur überleben, sondern sogar wachsen und gedeihen.[5] Die beiden nahe beieinander liegenden Quellen Octopus Spring und Mushroom Spring im unteren Geysir-Becken des Yellowstone-Nationalparks spielen dabei eine bedeutende Rolle. Von besonderem Interesse sind die mikrobiellen Gemeinschaften im Quellbecken und im Abfluss des Mushroom Spring in einem Temperaturbereich bis hinab auf (nur noch) ca. 45° C. Die mikrobielle Gemeinschaft im Unterboden der Quelle und der Abflüsse zeigte sich extrem uneinheitlich. Zwischen 40 und 69° C bilden sich phototrophe mikrobielle Matten.[3] Neben den für die Anwendung der Polymerase-Kettenreaktion (PCR) bedeutsamen Bakterien der Gattung Thermus wurden in den mikrobiellen Matten der Quelle bzw. der Abflüsse wie auch beim nahe gelegenen Octopus Spring Vertreter der Cyanobakterien,[3] der Grünen Nichtschwefelbakterien (Choroflexi)[3] sowie der Grünen Schwefelbakterien (Chlorobi)[6] gefunden. Dazu kommt eine neue Gruppe mit der Bezeichnung Acidobacteriota. Die Metagenomik zeigte dort vorherrschend fadenförmige, anoxygene Chloroflexi der Gattung Roseiflexus.[3] Die Stickstofffixierung scheint auf Synechococcus spp.[A. 1] in der oberen Mattenschicht und Thermodesulfovibrio sp. in der Untermatte beschränkt zu sein, der Nitrat-/Nitritstoffwechsel zeigte sich bei dieser Quelle limitiert. Ein geschlossener Schwefelkreislauf wird durch die biologische Reduktion von Sulfat in Verbindung Genen für die Oxidation von Sulfid hauptsächlich in phototrophen Mikroorganismen möglich.[3] Außerdem besitzen eine Reihe von Mikroorganismen im Bodenwasser Gene für die Produktion bzw. den Verbrauch von Wasserstoff, womit die beobachteten Muster der Wasserstoffkonzentration erklärt werden können.[3] Deinococcus-Thermus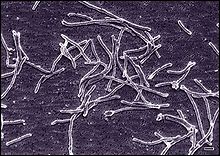 1969 isolierten Thomas D. Brock und Hudson Freeze von der Indiana University aus dem Mushroom Spring einen solch extrem thermophilen Bakterienstamm, den sie als Thermus aquaticus YT-1 bezeichneten; er war der erste Vertreter der Gattung Thermus.[7][8] Seitdem wurden weitere Spezies und Stämme dieser Gattung aus dem Phylum Deinococcus-Thermus in ähnlichen Umgebungen auf der ganzen Welt gefunden.[4] Insbesondere wurden T. aquaticus selbst zusammen mit mehreren anderen Vertretern der Gattung im nahe gelegenen Octopus Spring gefunden.[9][10][11][12] Der Stamm T. thermophilus HB8 (ursprünglich der als Stamm einer Spezies Flavobacterium thermophilum beschrieben,[13] ab 1974 zur Gattung Thermus verschoben).[14] Dieser wurde im September 1968 von Tairo Oshima aus Proben von der heißen Quelle Mine Onsen (alias Mine Hot Spring)[15] auf der Izu-Halbinsel (Japan) isoliert (Yoshida & Oshima, 1971).[13][16][17] Mit Hilfe der thermostabilen DNA-Polymerasen von T. aquaticus (den Taq-Polymerasen) wurde die 1983 von Kary Mullis die PCR (polymerase chain reaction) so weit verbessert und weiterentwickelt, dass sie erstmals in großem Umfang in der Praxis eingesetzt werden konnte.[18][19][12] Das Verfahren wurde kontinuierlich in Richtung noch höherer Thermotoleranz und geringerer Fehlerquote weiterentwickelt; zunächst kamen die DNA-Polymerasen von T. thermophilus (Tth-Polymerasen) hinzu. Inzwischen finden auch in diesem Sinn noch besser geeignete DNA-Polymerasen aus (anderswo gefundenen) thermophilen Archaeen wie Pyrococcus furiosus (Pfu-Polymerasen) und Thermococcus litoralis (Vent-Polymerasen) Anwendung.[18][19] ChloroflexiUnter den Chloroflexi fanden sich hier (wie auch im Octopus Spring) Vertreter der Gattungen Roseiflexus, Chloroflexus sowie Anaerolineae-ähnliche Arten.[6] ChlorobiUnter den Chlorobien fanden sich hier (ebenfalls wie auch im Octopus Spring) „Candidatus Thermochlorobacter aerophilus“[20] syn. „Ca. T. aerophilum“,[20][21][22] Familie Thermochlorobacteraceae bzw. Chloroherpetonaceae in der Ordnung Chlorobiales. Referenzstamm ist OS GSB[20] (oder kurz OS[21][22]).[6] AcidobacteriotaEntdeckt wurde zudem „Candidatus Chloracidobacterium thermophilum“, diese Spezies wird heute meist den Blastocatellia (früher genannt Acidobacteria subdivision 4)[23][24] (oder den Terriglobia[25]) in Phylum Acidobacteriota zugerechnet.[23][24][25][6] Referenzstamm ist B alias ATCC BAA-2647 oder JCM 3019.[25] Weblinks
Anmerkungen
Einzelnachweise
|
||||||||||||||||||||||
Portal di Ensiklopedia Dunia
