|
Fischer-Helferich-GlykosylierungDie Fischer-Helferich-Glykosylierung ist eine Namensreaktion der organischen Chemie. Sie ist die säurekatalysierte Synthese von O- oder S-Glykosiden.[1] Die Reaktion wurde 1893 das erste Mal vom deutschen Chemiker Emil Fischer (1852–1919) publiziert[2] und anschließend von seinem Schüler und späteren Assistenten Burckhardt Helferich (1887–1982) modifiziert.[3] ÜbersichtsreaktionBei der Synthese reagieren Monosaccharide wie Aldosen oder Ketosen mit einem Alkohol oder Thiol.[4] O-GlykosideBei der säurekatalysierten Reaktion mit einem Alkohol – z. B. Methanol – kommt es bei der Galactose zum Austausch der Hydroxygruppe und als Produkt wird ein O-Glykosid als Anomerengemisch erhalten: 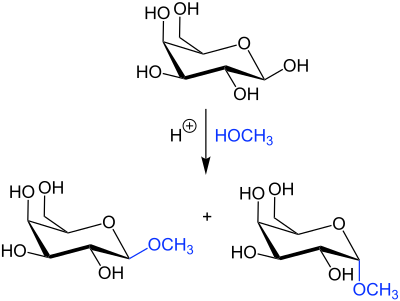 S-GlykosideWird bei der Reaktion anstelle eines Alkohols ein Thiol (im Beispiel Methylmercaptan) verwendet entsteht als Produkt das Anomerengemisch eines S-Glykosids:  ReaktionsmechanismusDer nachfolgende Mechanismus wird in der Literatur[1] beschrieben und beispielhaft anhand der Reaktion von Galactose mit Methanol erläutert:  Durch die Zugabe einer Säure (z. B. HCl) kommt es zur Anlagerung eines Protons an die Hydroxygruppe der Galactose 1. Das führt dazu, dass es im nächsten Schritt zu Abspaltung von Wasser kommt und das mesomeriestabilisierte Carboxonium-Ion gebildet wird. An das Carbeniumion 2 lagert sich das freie Elektronenpaar des Methanols an, sodass sich als Zwischenstufe das Oxonium-Ion 3 bildet. Durch Elektronenumlagerung kommt es zur Abspaltung eines Protons, als Produkt wird das O-Glykosid 4 als Anomerengemisch erhalten. Einzelnachweise
|
Portal di Ensiklopedia Dunia