|
Ethenon
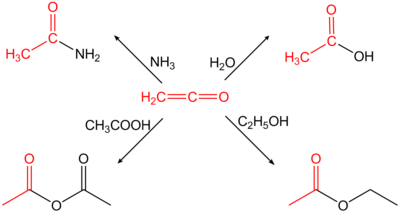
Ethenon oder auch Keten (Betonung auf der zweiten Silbe: Keten) ist die einfachste chemische Verbindung aus der Gruppe der Ketene und kann als inneres Anhydrid der Essigsäure aufgefasst werden. Gewinnung und DarstellungKeten entsteht durch Dehydratisierung von Essigsäure oder bei der Pyrolyse von Aceton. So wird beim Leiten von Acetondämpfen durch erhitzte Rohre oder elektrisch beheizte Metalldrähte bei 500–600 °C in Gegenwart von wenig Schwefelkohlenstoff Ethenon neben Methan in Ausbeuten bis 95 % d.Th. gebildet.[5][6] Die Ketonpyrolyse ist in der industriellen Chemie inzwischen von der Dehydratisierung von Essigsäure (Schmidlin-Bergman[7]-Wilsmore-Reaktion) weitgehend abgelöst worden. Im Labor kann Keten durch die Umsetzung von Acetylchlorid mit einem tertiären Amin dargestellt werden. Ethenon wurde etwa zeitgleich von Hermann Staudinger[8] – durch Reaktion von Bromacetylbromid mit metallischem Zink – und Norman Thomas Mortimer Wilsmore[9] – durch thermische Zersetzung von Essigsäureanhydrid – gefunden. EigenschaftenEthenon ist chemisch instabil. Das Gas ist nur bei tiefen Temperaturen (−80 °C) einigermaßen beständig. Es muss daher für jede Verwendung stets neu hergestellt und gleich weiterverarbeitet werden, da sonst eine Dimerisierung zu Diketen erfolgt bzw. eine Reaktion zu schwer handhabbaren Polymeren. Der Polymeranteil bei der Herstellung von Diketen wird daher auch z. B. durch Zugabe von Schwefeldioxid zum Ketengas oder den Reaktionsmedium verringert.[10] Wegen seiner kumulierten Doppelbindungen ist Ethenon sehr reaktiv und addiert H-azide Verbindungen nucleophil zu den entsprechenden Essigsäurederivaten; so hydrolysiert es z. B. mit Wasser zu Essigsäure oder reagiert mit prim. oder sek. Aminen zu den entsprechenden Acetamiden. Keten ist hochgiftig; die Toxizität beträgt etwa das Achtfache von Phosgen.[11] VerwendungEthenon dient zur Herstellung von Essigsäureanhydrid aus Essigsäure. Allgemein es wird zur Acetylierung von chemischen Verbindungen verwendet.[11]
Ethenon reagiert mit Formaldehyd in Gegenwart von Lewis-Säuren wie AlCl3, ZnCl2 oder BF3 als Katalysatoren zu β-Propiolacton.[12] Die technisch bedeutendste Verwendung von Ethenon ist die Synthese von Sorbinsäure durch Reaktion von Crotonaldehyd (2-Butenal) mit Keten in Toluol bei ca. 50 °C in Anwesenheit von Zinksalzen langkettiger Carbonsäuren. Dabei entsteht ein Polyester der 3-Hydroxy-4-hexensäure, der thermisch[13] oder hydrolytisch zu Sorbinsäure depolymerisiert wird. SicherheitshinweiseEthenon neigt zur spontanen Polymerisation. Der Kontakt mit Wasserstoffperoxid führt zu explosivem Diacetylperoxid.[14] Die Dämpfe von Keten können mit Luft ein explosionsfähiges Gemisch bilden. Einzelnachweise
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia