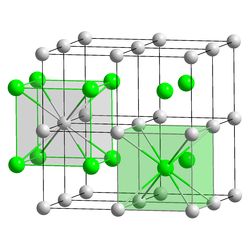
Kristallstruktur
_ Cs+ 0 _ I−
Kristallsystem
kubisch
Raumgruppe
Pm 3 m (Nr. 221)Vorlage:Raumgruppe/221
Gitterparameter
a=4,5679 Å
Koordinationszahlen
Cs[8], I[8]
Allgemeines
Name
Caesiumiodid
Andere Namen
Cäsiumjodid
Verhältnisformel
CsI
Kurzbeschreibung
farb- und geruchloser Feststoff[ 1]
Externe Identifikatoren/Datenbanken
Eigenschaften
Molare Masse
259,83 g·mol −1
Aggregatzustand
fest[ 1]
Dichte
4,51 g·cm−3 [ 1]
Schmelzpunkt
626 °C [ 1]
Siedepunkt
1280 °C[ 2]
Löslichkeit
gut in Wasser (440 g·l−1 bei 20 °C)[ 3]
Brechungsindex
1,7873[ 4]
Sicherheitshinweise
Toxikologische Daten
2386 mg·kg−1 (LD50 , Ratte , oral )[ 1]
Thermodynamische Eigenschaften
ΔHf 0
−347 kJ·mol−1 [ 6]
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie , 20 °C
Caesiumiodid (auch Cäsiumjodid) ist ein weißes, kristallines Salz mit der Summenformel Cs I , das in der IR- , UV- und Röntgenspektroskopie gebraucht wird. Es ist ein Salz der Iodwasserstoffsäure . Das Material ist sehr weich, schwierig zu polieren und empfindlich gegenüber Luftfeuchte . Die maximale Anwendungstemperatur beträgt 200 °C.
Eigenschaften
Caesiumiodid besitzt einen Brechungsindex von 1,73916 und einen Reflexions verlust von 13,6 % bei einer Wellenlänge von 10,0 µm. Es ist lichtdurchlässig im Bereich 0,24–70 µm. Die Wärmeleitfähigkeit beträgt 1,13 W/(m · K) und die spezifische Wärmekapazität beträgt 201 J/(kg · K).
Caesiumiodid ist hitzestabil bis etwa 600 °C, die thermische Zersetzung setzt bei 670–800 °C ein.[ 7]
Die Standardbildungsenthalpie von Caesiumiodid beträgt ΔH f 0 = −347 kJ/mol.[ 6]
Anwendung
CsI(Tl) für Szintillator Caesiumiodid kann als transparentes Szintillationsmaterial in Szintillationszählern verwendet werden. Die hochenergetische Strahlung erzeugt im Kristall einen sogenannten elektromagnetischen Schauer , dessen Photonen dann mit einem Photomultiplier in ein messbares elektrisches Signal verwandelt werden. Es kann undotiert oder mit Thallium (Tl) oder Natrium (Na) dotiert als Szintillationsmaterial verwendet werden.
Als undotiertes Material wird es auch in der IR-Spektroskopie als Strahlenteiler verwendet.[ 8]
Siehe auch
Weblinks
Einzelnachweise
↑ a b c d e Datenblatt Caesiumiodid Alfa Aesar , abgerufen am 16. Februar 2010 (Seite nicht mehr abrufbar) .
↑ Eintrag zu Caesium-Verbindungen . In: Römpp Online .
↑ CRC: Handbook of Chemistry and Physics . 55th edition. CRC-Press, 1974, ISBN 0-87819-454-1 .
↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics Index of Refraction of Inorganic Crystals , S. 10-246.
↑ a b Eintrag zu Cäsiumiodid GESTIS-Stoffdatenbank des IFA , abgerufen am 20. Januar 2022.
↑ a b A. F. Holleman , E. Wiberg , N. Wiberg : Lehrbuch der Anorganischen Chemie .ISBN 3-11-012641-9 , S. 1170.↑ I. A. Kulikov, M. L. Malyshev: Radiation-chemical decomposition of CsI . In: Atomic Energy 1983, 55 (5), S. 316–318. doi :10.1007/BF01123994
↑ E. Riedel: Anorganische Chemie . 8. Auflage, de Gruyter, Berlin 2011, ISBN 9783110225679 . S. 624.