|
নিউট্ৰন
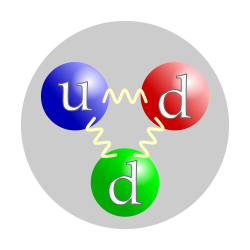
নিউট্ৰন হৈছে এটা উপ-পাৰমাণৱিক কণা (চিহ্ন- n অথবা n0 পৰমাণুৰ ৰাসায়নিক ধৰ্ম প্ৰধানকৈ ইয়াৰ গধুৰ নিউক্লিয়াছটোক প্ৰদক্ষিণ কৰা ইলেকট্ৰনৰ বিন্যাসৰ দ্বাৰা নিৰ্ধাৰিত হয়। ইলেকট্ৰনৰ বিন্যাস নিউক্লিয়াছৰ আধানৰ দ্বাৰা নিৰ্ধাৰিত হয়, যিটো প্ৰ'টনৰ সংখ্যা বা পাৰমাণৱিক সংখ্যাৰ ওপৰত নিৰ্ভৰ কৰে। নিউট্ৰনৰ সংখ্যাই ইলেকট্ৰনৰ বিন্যাসত কোনো প্ৰভাৱ নেপেলায়। একেবিধ মৌলৰে কেৱল নিউট্ৰনৰ সংখ্যাৰ পাৰ্থক্য থকা পৰমাণুবোৰক সমস্থানিক বোলা হয়। উদাহৰণস্বৰূপে, কাৰ্বনৰ (পাৰমাণৱিক সংখ্যা ৬) দুটা সমস্থানিক আছে। ইয়াৰে ৬ টা নিউট্ৰনযুক্ত কাৰ্বন-১২ সমস্থানিকটো প্ৰচুৰ পৰিমাণে পোৱা যায়, আৰু ৭টা নিউট্ৰনযুক্ত কাৰ্বন-১৩ সমস্থানিকটো বিৰল। কিছুমান মৌলক প্ৰকৃতিত এটা মাত্ৰ সুস্থিৰ সমস্থানিকৰ ৰূপত দেখা যায় (যেনে ফ্ল'ৰিন)। আন কিছুমান মৌল বহুতো সুস্থিৰ সমস্থানিকৰ সৈতে দেখা যায়। যেনে টিনৰ দহটা সুস্থিৰ সমস্থানিক আছে। টেকনিচিয়ামৰ দৰে মৌলৰ কোনো সুস্থিৰ সমস্থানিক নাই। পাৰমাণৱিক নিউক্লিয়াছত থকা নিউট্ৰনপাৰমাণৱিক নিউক্লিয়াছ পাৰমাণৱিক বলৰ দ্বাৰা একেলগে বান্ধ খাই থকা কেইটামান প্ৰ'টন, Z (পৰমাণু সংখ্যা ) আৰু নিউট্ৰনৰ, N ( নিউট্ৰন সংখ্যা) দ্বাৰা গঠিত হয় । প্ৰ'টন আৰু নিউট্ৰনৰ উভয়ৰে ভৰ প্ৰায় এক ডেল্টন। পৰমাণু সংখ্যাই পৰমাণুৰ ৰাসায়নিক ধৰ্ম নিৰ্ধাৰণ কৰে আৰু নিউট্ৰন সংখ্যাই সমস্থানিক বা নিউক্লাইড নিৰ্ধাৰণ কৰে। সমস্থানিক আৰু নিউক্লাইড শব্দ দুটা প্ৰায়ে সমাৰ্থকভাৱে ব্যৱহাৰ কৰা হয়, কিন্তু ইয়াৰ দ্বাৰা ক্ৰমে ৰাসায়নিক আৰু নিউক্লীয় ধৰ্মক বুজোৱা হয়। সমস্থানিক হৈছে একে পৰমাণু সংখ্যাৰ নিউক্লাইড, কিন্তু নিউট্ৰন সংখ্যা বেলেগ। একে নিউট্ৰন সংখ্যাৰ, কিন্তু বেলেগ পৰমাণু সংখ্যাৰ নিউক্লাইডক আইছ'টন বোলা হয়। পাৰমাণৱিক ভৰ সংখ্যা A, পাৰমাণৱিক সংখ্যা আৰু নিউট্ৰন সংখ্যাৰ যোগফলৰ সমান। একেটা পাৰমাণৱিক ভৰ সংখ্যাৰ, কিন্তু বেলেগ বেলেগ পৰমাণু আৰু নিউট্ৰন সংখ্যাৰ নিউক্লাইডক সমভাৰী (আইছ'বাৰ) বোলা হয়। নিউক্লিয়াছৰ ভৰ সদায় ইয়াৰ প্ৰ'টন আৰু নিউট্ৰন ভৰৰ যোগফলতকৈ অলপ কম: ভৰৰ পাৰ্থক্যই নিউক্লীয় বান্ধনি শক্তিৰ সমতুল্য ভৰক প্ৰতিনিধিত্ব কৰে, যিখিনি শক্তি নিউক্লিয়াছক খণ্ডিত কৰিবলৈ যোগ দিব লাগিব।
 নিউক্লিয়াছৰ ভিতৰৰ নিউক্লীয় বলৰ প্ৰভাৱত প্ৰ’টন আৰু নিউট্ৰনে প্ৰায় একে ধৰণে আচৰণ কৰে। সেয়েহে ইহঁত দুয়োটাকে সামূহিকভাৱে নিউক্লিয়ন বুলি কোৱা হয়। প্ৰ'টন আৰু নিউট্ৰনক একেটা কণিকাৰ দুটা কোৱাণ্টাম অৱস্থা হিচাপে ধৰি লোৱা আইছ'স্পিনৰ ধাৰণাটো নিউক্লীয় বা দুৰ্বল বলৰ সৈতে নিউক্লিয়নৰ আন্তঃক্ৰিয়াৰ আৰ্হি প্ৰস্তুত কৰিবলৈ ব্যৱহাৰ কৰা হয়। নিউক্লীয় শক্তিকম দূৰত্বত নিউক্লীয় বলৰ প্ৰচুৰ শক্তিৰ বাবেই পৰমাণুত ইলেকট্ৰনক বান্ধি ৰখা বিদ্যুৎচুম্বকীয় শক্তিতকৈ নিউক্লিয়নবোৰক বান্ধি ৰখা নিউক্লীয় শক্তিৰ মাত্ৰা কেবাটাও ক্ৰমেৰে বেছি। নিউক্লীয় বিভংগন প্ৰক্ৰিয়াত কিছুমান গধুৰ নিউক্লাইডে (যেনে ইউৰেনিয়াম-২৩৫) নিউট্ৰন শোষণ কৰিলে নিউক্লাইডটো অস্থিৰ হৈ পৰে আৰু কম ভৰৰ নিউক্লাইড আৰু অতিৰিক্ত নিউট্ৰনলৈ খণ্ডিত হ'ব পাৰে। ধনাত্মক আধানযুক্ত পাতল নিউক্লাইড বা "বিভাজিত খণ্ড"বোৰৰ মাজত বিকৰ্ষণৰ সৃষ্টি হয় আৰু বিদ্যুৎচুম্বকীয় স্থিতি শক্তিৰ উদ্ভৱ হয়। যদি এই বিক্ৰিয়াটো বিভাজনকাৰী পদাৰ্থৰ ভৰৰ মাজতে ঘটে, তেন্তে অতিৰিক্ত নিউট্ৰনসমূহে অতিৰিক্ত বিভংগন প্ৰক্ৰিয়াৰ সৃষ্টি কৰে, যাৰ ফলত নিউক্লীয় শৃংখল বিক্ৰিয়া নামেৰে জনাজাত শৃংখলা এটাৰ সৃষ্টি হয়। এক নিৰ্দিষ্ট ভৰৰ বাবে এনে নিউক্লীয় বিক্ৰিয়াই প্ৰচলিত ৰাসায়নিক বিস্ফোৰক পদাৰ্থৰ তুলনাত প্ৰায় দহ নিযুত গুণ শক্তি মুক্ত কৰে। নিউক্লীয় বলে নিউক্লীয় উপাদানসমূহৰ বিদ্যুৎচুম্বকীয় বিকৰ্ষণৰ পৰা উদ্ভৱ হোৱা শক্তিক জমা কৰাৰ ক্ষমতাই হৈছে নিউক্লীয় বিকাৰক বা বোমা সম্ভৱ কৰি তোলা বেছিভাগ শক্তিৰ ভেটি; বিভাজনৰ পৰা মুক্ত হোৱা শক্তিৰ সৰহখিনিয়েই বিভাজিত খণ্ডবোৰৰ গতিশক্তি। তথ্যসূত্ৰ
|
||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia