|
جهد كيميائيكمون كيميائي
في الكيمياء،الكمون الكيميائي أو الجهد الكيميائي [2] (بالإنجليزية: chemical potential) يرمز له بالرمز µ، وقد وضعه الفيزيائي والرياضي الأمريكي ويلارد جيبس، الذي عرفه كما يلي: «إذا أضفنا كمية متناهية في الصغر من مادة ما لأي كتلة في حالة التوازن، بحيث تبقى الكتلة متجانسة ويبقى الأنتروبي والحجم ثابتين، عندئذ يُعطى الكمون الكيميائي بالزيادة في طاقة الكتلة مقسومة على المادة المضافة لتلك الكتلة». وأشار جيبس أيضا إلى أن أي عنصر كيميائي، أو تركيب من عناصر بأي نسب معروفة قد يعتبر مادة متجانسة. في بعض الحقول العلمية، وبالذات علم الكيمياء الكهربائية يستخدم التعبير «الجهد الكيميائي» لوصف شيء آخر تماما، لكنه ينتمي إلى نفس الطبيعة وهو «الجهد الكيميائي الداخلي»، (انظر أسفله: الجهد الكيميائي الداخلى والخارجي، والكلي). وحدة الكمون الكيميائي هي جول/مول. وصفهالكمون الكيميائي μ يحدد خصائص مادة ما:
ويتم التفاعل الكيميائي، أو تحول طور المادة (مثل من ثلج إلى ماء)، أو النفاذية والتوزع من نفسه إذا كان الكمون الكيميائي للحالة الابتدائية أكبر منه للحالة النهائية. أي أن الكمون الكيميائي يستطيع وصف جميع أنواع تحولات المادة وكذلك تفاعلاتها التي تشترك فيها فوتونات أو فونونات، أو إلكترونات أو ثغرات إلكترونية. امثلة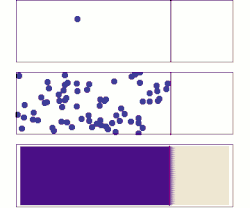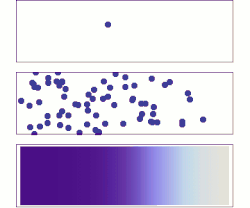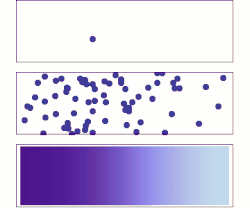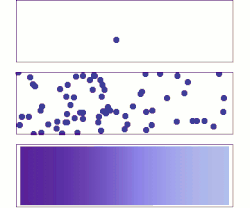
 انتشار الغاز يعادل انتشار الكمون الكيميائي. لنفرض توزيع كمون كيميائي كما في الشكل على مساحة ثنائية البعد. تميل الجزيئات إلى التحرك من المناطق ذات الكمون الكيميائي العالي (اللون الغامق) إلى المناطق ذات الكمون الكيميائي المنخفض (اللون الفاتح). مختلف صفات الحركة الحرارية تحدد ماهية الكمون الكيميائي. لنعتبر مثلاً ذرات مشحونة موجودة في سائل ما. فبحسب تدرج الضغط في السائل تندفع جزيئات من جهة عالية الضغط إلى أخرى منخفضة الضغط حتى يتساوى الضغط في جميع أجزاء النظام. وبالنسبة لتدرج الكمون الكهربائي (للشحنات) تندفع الجزيئات ذات الشحنة من الأماكن عالية الشحنة إلى أماكن منخفضة الشحنة حتى يتساوى توزيع الشحنات، وقد يكون ذلك في اتجاه معاكس بالنسبة للانتشار تحت ضغط. تاريخقدم جيبس في عام 1873 مقالة وضح فيها الخطوط الأولية لمعادلته الجديدة القادرة على تنبؤ أو تخمين نشوء مختلف النظم الطبيعية وذلك عند احتكاك الأجسام أو النظم ببعضها. استطاع جيبس بعد دراسة تفاعل مواد متجانسة مع بعضها، تحديد ثلاث حالات للتوازن: مستقر، متعادل، غير مستقر، وإذا كان التفاعل سيتم أم لا. في عام 1873، اعتمد جيبس على هذه الهيكلية في تقديم مبدأ الكمون الكيميائي الذي يأخذ بعين الاعتبار التفاعلات الكيميائية وحالة الأجسام المختلفة كيميائيا عن بعضها. يقول جيبس ملخصا نتائجه في عام 1973: حيث تشير ε إلى الطاقة الداخلية للجسم، وη تشتير إلى أنتروبية الجسم، و هو حجم الجسم. الجهد الكيميائي الداخلي، والخارجي، والكليعندما يوجد فرق في الجهد الكيميائي بين موضعين، يكون جزء منه ناشئ عن جهد خارجي مثل طاقة الجهد الكهربائي أو اختلاف طاقة الوضع وغيرها، بينما باقي الجهد يكون من عوامل داخلية في النظام مثل الكثافة، ودرجة الحرارة، والضغط وغيرها. [3] ويسمى الجهد الكيميائي الحقيقي الجهد الكيميائي الكلي ، وهو كما رأينا ينقسم إلى قسمين الجهد الكيميائي الداخلي ، والجهد الكيميائي الخارجي : حيث الكمون الخارجي: أي أن الجهد الخارجي هو مجموع الجهود المؤثرة من الخارج على النظام مثل الجهد الكهربائي، وجهد الجاذبية...وغيرها، حيث:
ومع أن التعبير «جهد كيميائي» أو «كمون كيميائي» تعني أساسا «الجهد الكيميائي الكلي» إلا أن البعض لا يراعي ذلك دائما. [3] وفي مجال الكيمياء الكهربائية يستخدم تعبير «الجهد الكيميائي» للتعبير عن «الجهد الكيميائي الداخلي» بينما يستخدم التعبير «الجهد الكيميائي الكهربي» لتعريف «الجهد الكيميائي الكلي». [4] الكمون الكيميائي الدينامي الحراريالكمون الكيميائي لنظام دينامي حراري هو كمية التغير في طاقة النظام عند إضافة جزيء واحد، مع بقاء الأنتروبية والحجم ثابتين. إذا احتوى النظام على صنفين من الجزيئات، فإنه يعرف كتغير في الطاقة عند ازدياد عدد جزيئات الأصناف جزيئا واحدا. الكمون الكيميائي هو متغير أساسي في الديناميكا الحرارية وهو يقترن بعدد الجزيئات. للكمون الكيميائي أهمية كبيرة عند دراسة نظم الجزيئات المتفاعلة. لنفترض حالة بسيطة من صنفين، حيث يتحول جزيء من الصنف الأول إلى جزيء من الصنف الثاني والعكس. فلنفترض مثلا مزيج مشبع من الماء (الصنف الأول)، وبخار الماء (الصنف الثاني). فإذا كان النظام في حالة توازن، فإن الكمونين الكيميائيين لكلا الصنفين يجب أن يكونا متساويين، وإلا نتجت حرارة من المزيج. ومن جهة أخرى، فإن أي زيادة في إحدى الكمونات الكيميائية سينتج عنه تحرير جزء من طاقة النظام على هيئة حرارة (عملية غير عكوسية) (انظر القانون الثاني للديناميكا الحرارية). عندما تتحول أصناف ذات «جهد كيميائي» كبير إلى أصناف أخرى يصدر النظام طاقة على هيئة حرارة، أما إذا أردنا عكس التفاعل فيلزم إمداد النظام بحرارة من الخارج. وفي التفاعلات الكيميائية تكون حالة التوازن الحراري معقدة كثيرا حيث تمتزج أكثر من صنفين اثنين. عندئذ نحسب العلاقة بين الجهود الكيميائية عند التوازن بواسطة قانون فاعلية الكتلة. ونظرا لأن الجهد الكيميائي هو كمية ترموديناميكية فهي تُعرّف بصرف النظر عن تصرفها الصغري في النظام، أي بخصائص الجزيئات المكونة للنظام. مثال توضيحي: نفترض أن لدينا 1 مول من الميثان و 2 مول من الأكسجين. فإذا قرّبنا شعلة من من ذلك المخلوط يحدث التفاعل التالي: ونتج عن التفاعل حرارة (طاقة). نتجت تلك الطاقة من الفرق في الجهد الكيميائي للميثان CH4 والأكسجين O2 الداخلين في التفاعل (كمون عالي)، والجهد الكيميائي ل ثاني أكسيد الكربون CO2 والماء H2O الناتجين من التفاعل (كمون منخفض). وتبلغ كمية الطاقة الناتجة من التفاعل: كما نجد أمثلة أخرى ممثة في البطاريات حيث تتحول الطاقة الكيميائية إلى طاقة كهربائية.
وهذه المعادلة تبين أن التفاعل يسير من اليسار إلى اليمين وينتج عنه حرارة، يسمى تفاعل ناشر للحرارة. وتبين أيضا أنه لكي نسيّر التفاعل العكسي من اليمين إلى اليسار، فلا بد لنا من تزويد التفاعل بحرارة من الخارج لكي يتم في هذا الاتجاه العكسي. توضيح التعريفنفترض نظاما ترموديناميكيا يحتوي على عدد n من اصناف الجزيئات. فتكون الطاقة الداخلية U معتمدة على الإنتروبيا S, والحجم V وعدد ذرات كل نوع N1,..., Nn. أي أن: وعندما نرمز للطاقة الداخلية ب U فإننا نعني أن الطاقة ناتجة من التفاعل بين أصناف جزيئات النظام، ولا تشترك أي مؤثرات خارجية على النظام. ويعرف الجهد الكيميائي للنوع i بالرمز μi وهو يعتبر الجزء النسبي الموجود في النظام المكون من عدد N من الجزيئات: حيث الحروف السفلى تبين أن إنتروبيا والحجم، وأعداد الذرات الأخرى ثابتة. كما يتضح من هذا التعبير أن وحدة الكمون الكيميائي هي جول/مول، بصفة عامة. وعند اعتبار الإنثالبي يمكننا كتابة معادلة الجهد اكيميائي كالآتي: في الأنظمة العملية يصعب عادة المحافظة على الإنتروبيا ثابتة حيث يحتاج ذلك إلى عزل ممتاز للنظام عن الخارج. ولذلك يستحسن لتعريف طاقة هلمهولتز الحرة A التي هي دالة لدرجة الحرارة T والحجم V وعدد الجزيئات N كالآتي: وباستخدام تعريف طاقة هلمهولتز الحرة نحصل على الجهد الكيميائي: وتجرى التجارب المعملية عادة عند درجة حرارة ثابتة وضغط ثابت. في تلك الحالة يكون الجهد الكيميائي هو مشتق جزئي ل طاقة جيبس بالنسبة إلي عدد الجزيئات: كما يمكن صياغة الجهد الكيميائي باسستخدام المشتقة الجزئية للإنثالبي (تحت ظروف ثبات الإنتروبيا والضغط الثابت). قمنا هنا بتعريف الكمون الكيميائي ككمية الطاقة لكل جزيئ، وتوجد تعريفات أخرى للكمون الكيميائي ككمية الطاقة لكل مول. الكمون الكيميائي والطاقة الداخليةتعرف معادلة جيبس الأساسية الطاقة الداخلية U بأنها: حيث:
ظروف التوازن الكيميائييكون الكمون الكيميائي للمواد الداخلة في التفاعل مساويا للكمون الكيميائي للمواد الناتجة من التفاعل عند التوازن الكيميائي. ذلك مثلما يحدث في حالة تساوي درجة الحرارة لنظامين كانا منعزلين وفي درجتي حرارة مختلفتين ثم وصلناهما ببعضهنا لبعض أو تساوي الجهد الكهربائي عند التوازن. ويمكننا عن طريق التحكم في بعض المتغيرات السيطرة على التوازن الكيميائي في حالات متعددة:
ونظرا لعملنا في المعامل الكيماوية يكون في ظروف ثبات درجة الحرارة وثبات الضغط فإننا نحصل على طاقة غيبس الحرة G وهي الطريقة الشائعة. ولكن حالة التوازن بصفة عامة تعبر عن اختفاء الفرق بين الكمونات الكيميائية (أي تساويها). مصطلحاتيعتمد مصطلح الكمون الكيميائي على السياق الذي يستخدم فيه:
المراجع
اقرأ أيضا |
Portal di Ensiklopedia Dunia
















