|
Hiperkolesterolemia familia
Hiperkolesterolemia familia atau Familial Hypercholesterolemia (FH) merupakan kelainan metabolik lemak dengan karakteristik berupa kelainan klinis yang ditandai dengan peningkatan kadar kolesterol dan lemak low density lipoprotein (LDL) dalam darah dan kelainan molekuler yang ditandai dengan tidak terdapatnya reseptor LDL. Hiperkolesterolemia familia merupakan dislipidemia monogenik yang diturunkan secara autosomal dominan. Sebagian besar disebabkan oleh mutasi gen reseptor LDL, apolipoprotein B, atau Proprotein Convertase Subtilisin Kexin type 9 (PCSK9) sehingga terjadi perubahan struktur maupun fungsi dari reseptor yang mengikat LDL dari sirkulasi. Penderita hiperkolesterolemia familia memiliki kadar kolesterol darah yang tinggi sejak lahir dan dapat menimbulkan aterosklerosis sejak usia anak-anak sehingga meningkatkan risiko terjadi kematian karena penyakit jantung koroner pada usia muda.[1] Tanda dan gejalaTanda fisikKadar kolesterol tinggi biasanya tidak menimbulkan gejala apapun. Pada orang dengan FH, bisa terjadi penumpukan lemak kaya kolesterol berwarna kuning di berbagai tempat seperti sekitar kelopak mata (dikenal sebagai xanthelasma palpebrarum), tepi luar iris (dikenal sebagai arcus senilis korneae), korne (arkus korneal), sendi (tuberous xanthomas), dan tendon tangan, siku, lutut dan kaki, terutama tendon Achilles (dikenal sebagai xanthoma tendon).[2][3] Penyakit kardiovaskularDeposisi kolesterol yang lebih cepat pada dinding arteri menyebabkan aterosklerosis yang menjadi penyebab utama penyakit kardiovaskular. Masalah paling umum pada FH adalah perkembangan penyakit arteri koroner (aterosklerosis arteri koroner yang menyuplai jantung) pada usia yang lebih muda daripada populasi umum. Hal ini dapat menyebabkan angina pektoris (nyeri dada atau sesak saat beraktivitas) atau serangan jantung. Pada kondisi lebih jarang, arteri otak dapat terpengaruh, hal ini dapat menyebabkan stroke dan serangan iskemik sementara (episode singkat kelemahan pada satu sisi tubuh atau ketidakmampuan untuk berbicara). Penyakit oklusif arteri perifer (penyumbatan arteri kaki) terjadi terutama pada orang dengan FH yang merokok, yang dapat menyebabkan nyeri pada otot betis saat berjalan tetapi hilang saat istirahat (klaudikasi intermiten) dan masalah karena penurunan suplai darah ke kaki (seperti gangren).[4] Risiko aterosklerosis semakin meningkat seiring bertambahnya usia dan pada mereka yang merokok, menderita diabetes, tekanan darah tinggi, dan riwayat keluarga dengan penyakit kardiovaskular.[2][5] DiagnosisTerdapat berbagai macam kriteria untuk mendeteksi hiperkolesterolemia familia pada dewasa, yaitu:[6][7]
Pengukuran lemakPada pemeriksaan laboratorium terdapat peningkatan kadar kolesterol total >300 mg/dL atau >250 mg/dL pada anak dan peningkatan kadar LDL >200 mg/dL.[8] Analisis mutasiBerdasarkan tingginya LDL dan kriteria klinis (yang berbeda di setiap negara), dapat dilakukan pengujian genetik untuk mutasi reseptor LDL dan mutasi ApoB. Mutasi terdeteksi antara 50 dan 80% kasus; orang dengan FH yang tidak bermutasi seringkali memiliki kadar trigliserida yang lebih tinggi dan mungkin sebenarnya memiliki penyebab lain untuk kolesterol tinggi, seperti hiperlipidemia gabungan karena sindrom metabolik.[9] Diagnosis pembandingFH perlu dibedakan dari hiperlipidemia gabungan familial dan hiperkolesterolemia poligenik. Kadar lipid dan adanya xanthomata dapat mengonfirmasi diagnosis FH. Sitosterolemia dan xanthomatosis serebrotendinosa merupakan dua penyakit langka yang juga dapat muncul dengan aterosklerosis dini dan xanthoma. Xanthoma juga dapat melibatkan manifestasi neurologis atau psikiatri, katarak, diare, dan kelainan tulang.[10] KlasifikasiHiperkolesterolemia familia dibagi menjadi:[6]
GenetikKelainan genetik paling umum pada FH adalah mutasi LDLR (prevalensi 1 dalam 250, tergantung pada populasi),[11] mutasi ApoB (prevalensi 1 dalam 1000), mutasi PCSK9 (kurang dari 1 dalam 2500) dan LDLRAP1. Penyakit terkait sitosterolemia, yang memiliki banyak kesamaan dengan FH dan juga menunjukkan akumulasi kolesterol dalam jaringan, disebabkan oleh mutasi ABCG5 dan ABCG8.[2] Reseptor LDL  Gen reseptor LDL terletak di lengan pendek kromosom 19 (19p13.1-13.3).[12] Gen terdiri dari 18 ekson membentang sepanjang 45 kb, dan produk protein mengandung 839 asam amino dalam bentuk matang. Orang dengan satu salinan abnormal (heterozigot) dari LDLR menyebabkan penyakit kardiovaskular pada usia 50 pada sekitar 40% kasus. Orang dengan dua salinan abnormal (homozigot) dari LDLR menyebabkan percepatan aterosklerosis pada masa kanak-kanak, termasuk komplikasinya. Kadar LDL plasma berbanding terbalik dengan aktivitas reseptor LDL (LDLR). Homozigot memiliki aktivitas LDLR kurang dari 2%, sedangkan heterozigot memiliki pemrosesan LDL yang rusak dengan aktivitas reseptor 2-25%, tergantung pada sifat mutasi. Telah ditemukan ada lebih dari 1000 mutasi yang berbeda dari LDLR pada FH.[2] Ada lima kelas utama FH karena mutasi LDLR:[13]
Apolipoprotein BApolipoprotein B dalam bentuk ApoB100 merupakan apolipoprotein utama, atau bisa berbentuk menjadi bagian protein dari partikel lipoprotein. Gen penyandi terletak pada kromosom kedua (2p24-p23) dan berukuran 46,2 kb. FH sering dikaitkan dengan mutasi R3500Q, yang menyebabkan penggantian arginin menjadi glutamin pada posisi 3500. Mutasi terletak pada wilayah yang biasanya berikatan dengan reseptor LDL, dan dengan mutasi ini membuat ikatannya berkurang. Seperti LDLR, jumlah salinan abnormal menentukan tingkat keparahan hiperkolesterolemia.[2][14] PCSK9Mutasi pada gen proprotein convertase subtilisin/kexin type 9 (PCSK9) dikaitkan dengan FH autosomal dominan (yaitu hanya membutuhkan satu salinan abnormal) dalam laporan tahun 2003.[15] Gen tersebut terletak pada kromosom pertama (1p34.1-p32) dan menyandi protein dengan 666 asam amino yang diekspresikan di hati. Telah dikemukakan bahwa PCSK9 menyebabkan FH terutama dengan mengurangi jumlah reseptor LDL pada sel-sel hati.[16] LDLRAP1Kelainan pada gen ARH, juga dikenal sebagai LDLRAP1, pertama kali dilaporkan dalam sebuah keluarga pada 1973, dan pengamatan pada empat keluarga dilaporkan pada 2001.[17] Berbeda dengan mutasi-mutasi yang sudah disebut sebelumnya, untuk dapat terjadi FH maka diperlukan dua salinan gen yang abnormal (resesif autosomal). Mutasi ini cenderung menyebabkan produksi protein yang diperpendek. Fungsi protein sebenarnya tidak jelas, tetapi tampaknya memainkan peran dalam hubungan antara reseptor LDL dan lubang berlapis klatrin. Orang dengan hiperkolesterolemia resesif autosomal cenderung memiliki penyakit yang lebih parah daripada LDLR-heterozigot, tetapi kurang parah daripada LDLR-homozigot.[2] Patofisiologi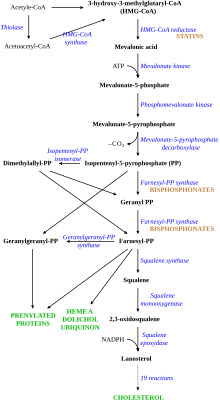 Kolesterol LDL secara normal bersirkulasi dalam tubuh selama 2,5 hari, dan selanjutnya bagian apolipoprotein B dari kolesterol LDL berikatan dengan reseptor LDL pada sel hati, memicu penyerapan dan pemecahannya.[12] Proses ini langkah untuk membuang LDL dari sistem peredaran darah. Sintesis kolesterol oleh hati ditekan di jalur HMG-KoA reduktase.[18] Pada FH, fungsi reseptor LDL berkurang atau bahkan tidak ada,[12] dan LDL bersirkulasi rata-rata selama 4,5 hari, sehingga meningkatkan kadar kolesterol LDL dalam darah secara signifikan, sedangkan kadar lipoprotein lainnya normal.[19] Pada mutasi ApoB, berkurangnya pengikatan LDL ke reseptor menyebabkan peningkatan kadar kolesterol LDL. Mutasi pada PCSK9 dan ARH juga dapat menyebakan disfungsi reseptor LDL, tetapi mekanismenya belum diketahui.[2] Aterosklerosis dapat terjadi pada semua orang, tetapi orang dengan FH lebih mungkin mengalami aterosklerosis pada usia yang lebih muda karena kadar LDL yang berlebihan. Derajat aterosklerosis kira-kira tergantung pada jumlah reseptor LDL yang masih diekspresikan dan fungsi reseptor tersebut. Dalam banyak bentuk FH heterozigot, fungsi reseptor hanya sedikit terganggu, dan kadar LDL akan tetap relatif rendah. Dalam bentuk homozigot yang lebih serius, reseptor tidak diekspresikan sama sekali.[2] Beberapa studi kohort FH menunjukkan bahwa faktor risiko tambahan umumnya berperan ketika seseorang mengalami aterosklerosis.[20][21] Selain faktor risiko klasik seperti merokok, tekanan darah tinggi, dan diabetes, penelitian genetik telah menunjukkan bahwa kelainan umum pada gen protrombin (G20210A) meningkatkan risiko kejadian kardiovaskular pada orang dengan FH.[5] Beberapa penelitian menemukan bahwa kadar lipoprotein(a) yang tinggi merupakan faktor risiko tambahan untuk penyakit jantung iskemik.[22] Risikonya juga ditemukan lebih tinggi pada orang dengan genotipe spesifik dari enzim pengubah angiotensin (ACE).[23] SkriningMenurut American Academy of Pediatrics skrining sebaiknya dilakukan pada usia 9-11 tahun dan usia 17-21 tahun.[24] Sedangkan pada usia skrining dilakukan pada usia 35 tahun untuk pria dan usia 45 tahun pada wanita. Hiperkolesterolemia dapat dicurigai bila kadar kolesterol >310 mg/dL dan kadar LDL >190 mg/dL.[7] PerawatanPenanganan Hiperkolesterolemia Familia bertujuan untuk menurunkan risiko aterosklerosis di mana terjadi penumpukan lemak pada dinding pembuluh darah. Penumpukan ini dapat menyebabkan penebalan dinding pembuluh darah, pengerasan dinding pembuluh darah, dan memblok pembuluh darah. Pilihan obat penurun lipid adalah golongan statin intensitas tinggi bersama dengan ezetimibe, gemfibrozil, fenofibrat, atau inhibitor PCSK9 dengan target kolesterol LDL <100 mg/dL dan LDL <70 mg/dL pada pasien dengan penyakit jantung koroner. Statin relatif aman diberikan pada anak. Pengobatan dengan golongan statin tidak diberikan pada ibu hamil atau menyusui, tetapi diberikan sekuestran asam empedu. Efek samping pengobatan yang pernah dilaporkan antara lain nyeri otot, nyeri perut, konstipasi, muntah, dan diare. Selain dengan obat-obatan, perlu dilakukan perubahan gaya hidup seperti perbanyak latihan fisik dan diet rendah lemak. EpidemiologiPrevalensi global FH yaitu sekitar 10 juta orang.[12] Pada sebagian besar populasi yang diteliti, FH heterozigot terjadi pada sekitar 1:250 orang, tetapi tidak semua menunjukkan gejala.[11] FH homozigot terjadi pada sekitar 1:1.000.000.[2] Mutasi LDLR lebih sering terjadi pada populasi tertentu, mungkin karena fenomena genetik yang dikenal sebagai efek pendiri —yaitu mutasi ditemukan oleh sekelompok kecil individu, satu atau beberapa di antaranya adalah pembawa mutasi. Orang Afrikaner, Perancis Kanada, Lebanon Kristen, dan Finlandia memiliki tingkat mutasi spesifik yang tinggi sehingga FH sangat umum dalam kelompok ini. Mutasi APOB lebih sering terjadi di Eropa Tengah.[2] SejarahCarl Müller adalah dokter Norwegia yang pertama kali mengaitkan tanda-tanda fisik, kadar kolesterol tinggi, dan pewarisan dominan autosomal pada 1938.[25] Pada awal 1970-an dan 1980-an, penyebab genetik FH dijelaskan oleh Dr Joseph L. Goldstein dan Dr Michael S. Brown dari Dallas, Texas. Awalnya, mereka menemukan peningkatan aktivitas HMG-KoA reduktase, tetapi penelitian menunjukkan bahwa peningkatan aktivitas enzim tersebut tidak menjelaskan kadar kolesterol yang sangat abnormal pada orang dengan FH.[26] Fokus bergeser ke pengikatan LDL ke reseptornya, juga efek gangguan pengikatan tersebut pada metabolisme. Dan hal ini terbukti menjadi mekanisme yang mendasari FH.[27][28] Selanjutnya, banyak mutasi pada protein secara langsung diidentifikasi dengan pengurutan DNA.[13] Mereka kemudian memenangkan Hadiah Nobel Fisiologi atau Kedokteran pada 1985 untuk penemuan reseptor LDL dan dampaknya pada metabolisme lipoprotein.[29] Referensi
|
||||||||||||||
