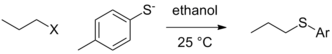|
Gugus pergiDalam ilmu kimia, suatu gugus pergi (disebut pula sebagai gugus lepas) adalah suatu fragmen molekul yang lepas dengan suatu pasangan elektron dalam pembelahan ikatan kimia secara heterolitik. Gugus pergi dapat berupa suatu anion atau molekul netral, tetapi dalam kedua kasus tersebut yang terpenting adalah bahwa gugus pergi dapat menstabilkan kerapatan elektron tambahan yang dihasilkan dari heterolisis ikatan.[1] Gugus pergi anionik yang umum adalah halida seperti Cl−, Br−, dan I−, serta ester sulfonat seperti tosilat (TsO−). Fluorida (F−) berfungsi sebagai gugus pergi dalam agen saraf gas sarin. Gugus pergi yang merupakan molekul netral yang umum adalah air dan amonia.[2] Gugus pergi dapat pula merupakan kation bermuatan positif (seperti H+ yang dilepaskan selama nitrasi benzena); hal ini juga secara spesifik dikenal sebagai electrofuge.[3][4] Kemampuan gugus pergi Akan sangat membantu untuk mempertimbangkan konsep kemampuan gugus pergi dalam hal tahap pertama dari reaksi SN1/E1 dengan suatu gugus pergi anionik (ionisasi), sambil mengingat bahwa konsep ini dapat digeneralisasi untuk semua reaksi yang melibatkan gugus pergi. Karena gugus pergi memikul muatan negatif yang lebih besar pada keadaan transisi (dan produk) daripada dalam bahan pemula, gugus pergi yang baik harus mampu menstabilkan muatan negatif ini, yaitu dalam bentuk anion yang stabil. Ukuran kestabilan anion yang baik adalah melalui pKa pada asam konjugat anion, dan kemampuan gugus pergi memang umumnya mengikuti tren ini, dengan pKaH yang rendah dikaitkan dengan kemampuan gugus pergi yang lebih baik. Kemampuan gugus pergi menunjukkan perbedaan energi antara bahan pemula dan keadaan transisi (ΔG‡), dan perbedaan dalam kemampuan gugus pergi tercermin dalam perubahan kuantitas ini (ΔΔG‡). Kuantitas pKaH, tetapi, menunjukkan perbedaan energi antara bahan pemula dan produk (ΔG) dengan perbedaan keasaman tercermin dalam perubahan kuantitas ini (ΔΔG). Juga, bahan pemula dalam kasus ini berbeda. Dalam kasus pKa, "gugus pergi" terikat dengan proton dalam bahan pemula, sedangkan dalam kasus kemampuan gugus pergi, gugus pergi terikat dengan (biasanya) karbon. Hal ini dengan peringatan yang penting diketahui bahwa seseorang harus mempertimbangkan pKaH agar mencerminkan kemampuan gugus pergi, tetapi bagaimanapun setiap tren cenderung berkorelasi dengan baik dengan satu sama lain. Konsisten dengan tabel berikut ini, basa kuat seperti OH−, OR− dan NR2− cenderung membuat gugus pergi yang buruk, karena ketidakmampuan mereka untuk menstabilkan muatan negatif.
Merupakan hal yang sangat jarang bagi gugus seperti H− (hidrida) dan R3C− (alkil anion, R=alkil atau H) untuk lepas dengan sepasang elektron karena basanya yang tidak stabil. Perbedaan kontekstual pada kemampuan gugus pergiPerbedaan kontekstual pada kemampuan gugus pergi dalam bentuk paling murni, yaitu ketika gugus yang sebenarnya yang akan pergi tidak terpengaruh oleh kondisi reaksi (oleh protonasi atau kompleksasi asam Lewis) dan lepasnya gugus pergi terjadi pada tahap penentu laju reaksi. Dalam situasi di mana variabel lainnya tetap konstan (sifat elektrofil alkil, pelarut, dll), perubahan nukleofil dapat menyebabkan perubahan dalam urutan reaktivitas pada gugus pergi. Dalam kasus di bawah ini, tosilat adalah gugus pergi yang terbaik ketika etoksida merupakan nukleofil, tetapi iodida dan bahkan bromida menjadi gugus pergi yang lebih baik dalam kasus nukleofil tiolat.[6]
AktivasiTransformasi gugus pergi yang lemah menjadi gugus pergi yang baik melalui protonasi atau kompleksasi dengan suatu asam Lewis seperti dalam reaksi E1 dan SN1 adalah hal yang umum. Karenanya, suatu molekul dapat secara formal kehilangan gugus pergi yang lemah melalui protonasi sebelum perginya molekul tersebut, seperti gugus hidroksida. Prinsip yang sama berlaku pada reaksi Friedel-Crafts. Dalam reaksi ini, suatu asal Lewis yang kuat diperlukan untuk menghasilkan baik karbokation dari suatu alkil halida dalam alkilasi Friedel-Crafts atau ion asilium dari suatu asil halida dalam asilasi Friedel-Crafts. 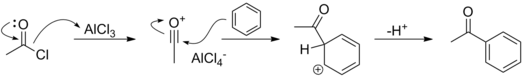 Dalam sebagian besar kasus, reaksi yang melibatkan aktivasi gugus pergi untuk menghasilkan kation berada dalam tahap yang terpisah, sebelum serangan nukleofilik atau eliminasi. Misalnya, reaksi SN1 dan E1 mungkin melibatkan tahap aktivasi, sedangkan reaksi SN2 dan E2 umumnya tidak melibatkan tahapan ini. Lihat pulaReferensi
|
|||||||||||||||||||||||||||||||||||||||||||||||||