|
Absorpsi (kimia)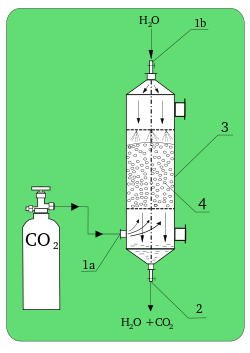  Dalam ilmu kimia, absorpsi atau penyerapan[1] adalah fenomena fisika atau kimia atau suatu proses di mana atom, molekul atau ion memasuki fase ruah – bahan cair atau padat. Absorpsi (penyerapan) berbeda dengan adsorpsi (penjerapan), karena molekul-molekul yang mengalami absorpsi memasuki volume, tidak hanya di permukaan saja (seperti yang terjadi pada adsorpsi). Istilah yang lebih umum adalah sorpsi (pengerapan) (bahasa Inggris: sorption), yang meliputi absorpsi, adsorpsi, dan pertukaran ion. Absorpsi adalah suatu kondisi di mana sesuatu memasuki zat lain.[2] Dalam banyak proses teknologi penting, absorpsi kimia digunakan untuk proses fisika, misalnya absorpsi karbon dioksida oleh natrium hidroksida – semacam proses asam-basa yang tidak mematuhi hukum partisi Nernst. Beberapa contoh efek ini dapat dilihat pada artikel ekstraksi cair-cair. Adalah hal yang mungkin untuk mengekstraksi suatu zat terlarut (solut) dari sastu fase cair ke fase cair lainnya tanpa reaksi kimia. Contoh solut semacam ini adalah gas mulia dan osmium tetroksida.[2] Proses absorpsi berarti bahwa zat menangkap dan memindahkan energi. Absorben mendistribusikan bahan yang ditangkapnya secara menyeluruh, sementara adsorben hanya mendistribusikannya di permukaan saja. Proses gas atau cair yang menembus ke dalam badan adsorben secara umum dikenal sebagai absorpsi.[3] Definisi IUPAC
PersamaanJika absorpsi adalah suatu proses fisika yang tidak berhubungan dengan proses fisika atau kimia, biasanya ia memenuhi hukum distribusi Nernst:
Nilai konstanta KN bergantung pada suhu dan disebut koefisien partisi.[4] Persamaan ini valid jika konsentrasi tidak terlalu besar dan jika spesies "x" tidak berubah bentuk dalam kedua fase. Jika molekul semacam ini mengalami asosiasi atau disosiasi, maka persamaan ini tetap dapat menjelaskan kesetimbangan antara "x" dalam kedua fase, tetapi hanya untuk bentuk yang sama – konsentrasi seluruh bentuk yang tersisa harus dikalkulasi dengan melibatkan kesetimbangan secara keseluruhan.[2] Dalam kasus absorpsi gas, perhitungan konsentrasi dapat dilakukan dengan menggunakan, misalnya Hukum gas ideal, c = p/RT.[5] Cara lainnya, dapat digunakan tekanan parsial untuk menggantikan konsentrasi. Jenis-jenis absorpsiAbsorpsi adalah suatu proses yang dapat berupa kimia (reaktif) maupun fisika (tak-reaktif).[4] Absorpsi kimiaAbsorpsi kimia atau absorpsi reaktif adalah reaksi kimia antara bahan yang diabsorpsi dan yang mengabsorbsi.[4] Kadang-kadang, ia merupakan kombinasi dengan absorpsi fisika. Absorpsi jenis ini bergantung pada stoikiometri reaksi dan konsentrasi reaktannya.[6] Referensi
|
Portal di Ensiklopedia Dunia
![{\displaystyle {\frac {[x]_{1}}{[x]_{2}}}={\text{constant}}=K_{N(x,12)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0ec1ce71d0ce27734b33e4d1dfae04be91ecf13)