维里状态方程 ,即维里展开 ,又称昂内斯方程 ,最初由卡末林·昂内斯 [ 1] 维里系数 和足够的温度项,那么它可以取代大量精密的PρT数据。这种维里状态方程可以在数学上取代大量的数据表,同时不需要理解底层的热力学 。
理想气体定律 可以用压缩系数Z(compressibility factor)表示:
Z
=
P
v
R
T
=
1
{\displaystyle Z={\frac {Pv}{RT}}=1}
T是绝对温度 ,R是通用气体常数 ,v是摩尔体积 。对于真正的气体和液体,Z不等于1,偏差取决于温度,压力和摩尔体积。其偏差可以用维里状态方程表示:
Z
=
P
R
T
ρ
=
A
+
B
ρ
+
C
ρ
2
+
D
ρ
3
+
E
ρ
4
+
F
ρ
5
+
⋯
{\displaystyle Z={\frac {P}{RT\rho }}=A+B\rho +C\rho ^{2}+D\rho ^{3}+E\rho ^{4}+F\rho ^{5}+\cdots }
其中ρ=1/v是流体的莫耳密度 ,這是表示流體PρT性質的最通用的狀態方程。A是第一維里系数,其值恆為1,表示在低莫爾密度下,所有流體接近理想氣體。維里係數B,C,D等是溫度的函數,並且通常以1/T的泰勒級數表示。壓縮係數是無單位數量,表明流體偏離理想氣體的程度。
第二和第三维里系数已被广泛研究一个多世纪,许多流体已有它们的表列。最广泛的表列在Dymonds的书中[ 2] [ 3] [ 4]
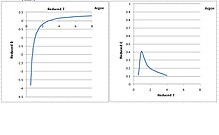
在Dymonds的书和WTT表中,由氩代表的第二和第三维里系数如右图所示。減縮温度和減縮维里系数都是无单位数量。大多数流体具有相同的系数曲线。
氩气的第二和第三減縮维里系数。 随着温度的降低,第二维里系数持续降低。然而,第三维里系数具有钟形。随着温度降低到临界温度,它升高到峰值,并随着温度从临界点降低到三点而迅速下降到0。由于第三维里系数理论上代表三个分子之间的排斥力,预计在较低的温度下会随着分子被压在一起而增加,所以在临界温度以下持续降低,不合乎物理學的預期。
第三维里系数临界温度以下降低的原因是计算错误。通常PρT等温线在气相中可以方便地测量。在临界温度以下,气相冷凝并与液相共存,PρT等温线变平。饱和压力不变,直到所有气体冷凝成液体,然后压力随密度增加而上升。在纯气相和纯液相之间存在一个很大的间隙,其中没有可用的压力数据(只有饱和压力)。如果仅仅分析气相中的数据,则第三维里系数变得非常小,因为PρT等温线在气相中几乎是线性的。然而,如果包括纯液相中的数据点,二阶回归法将给出相当大的第三维里系数。由此导出的第三维里系数随着温度降低而持续增加。
有些状态方程能准确预测气相和液相共存的饱和区中的PρT等温线,我们可以用这些状态方程来验证第三维里系数与1/T的函数关系。大多数状态方程可以转化为维里方程,从而可以比较它们所产生的第二和第三维里系数。
大多数状态方程可以改寫為维里方程,这样就可以准确地互相评估和比较它们隐含的第二和第三维里系数。
1873年凡得瓦 提出了他著名的状态方程[ 5]
P
=
R
T
(
v
−
b
)
−
a
v
2
{\displaystyle P={\frac {RT}{\left(v-b\right)}}-{\frac {a}{v^{2}}}}
其中v=1/ρ是摩尔体积。我們可以将1/(v-b)扩展为泰勒级数来重新排列:
Z
=
1
+
(
b
−
a
R
T
)
ρ
+
b
2
ρ
2
+
b
3
ρ
3
+
⋯
{\displaystyle Z=1+\left(b-{\frac {a}{RT}}\right)\rho +b^{2}\rho ^{2}+b^{3}\rho ^{3}+\cdots }
第二维里系数大致正确,因为当温度降低时它变为负值。第三和更高的维里系数与温度无关,這是不正确的,特别是在低温下。
所有随后由van der Waals方程導出的状态方程,如Dieterici[ 6] [ 7] [ 8] [ 9]
然而,由Beattie-Bridgeman[ 10]
p
=
R
T
v
2
(
1
−
c
v
T
3
)
(
v
+
B
)
−
A
v
2
{\displaystyle p={\frac {RT}{v^{2}}}\left(1-{\frac {c}{vT^{3}}}\right)(v+B)-{\frac {A}{v^{2}}}}
其中
A
=
A
0
(
1
−
a
v
)
{\displaystyle A=A_{0}\left(1-{\frac {a}{v}}\right)}
B
=
B
0
(
1
−
b
v
)
{\displaystyle B=B_{0}\left(1-{\frac {b}{v}}\right)}
可以重新排列:
Z
=
1
+
(
B
0
−
A
0
R
T
−
c
R
T
3
)
ρ
−
(
B
0
b
−
A
0
a
R
T
3
)
ρ
2
+
(
B
0
b
c
T
3
)
ρ
3
{\displaystyle Z=1+\left(B_{0}-{\frac {A_{0}}{RT}}-{\frac {c}{RT^{3}}}\right)\rho -\left(B_{0}b-{\frac {A_{0}a}{RT^{3}}}\right)\rho ^{2}+\left({\frac {B_{0}bc}{T^{3}}}\right)\rho ^{3}}
该状态方程的第二维里系数与实验数据非常接近。然而,第三个维里系数的負號是错误的。因此,它不能正確表示接近临界温度上下的等温线。
1940年的Benedict-Webb-Rubin状态方程[ 11]
Z
=
1
+
(
B
0
−
A
0
R
T
−
C
0
R
T
3
)
ρ
+
(
b
−
a
R
T
)
ρ
2
+
(
α
a
R
T
)
ρ
5
+
c
ρ
2
R
T
3
(
1
+
γ
ρ
2
)
exp
(
−
γ
ρ
2
)
{\displaystyle Z=1+\left(B_{0}-{\frac {A_{0}}{RT}}-{\frac {C_{0}}{RT^{3}}}\right)\rho +\left(b-{\frac {a}{RT}}\right)\rho ^{2}+\left({\frac {\alpha a}{RT}}\right)\rho ^{5}+{\frac {c\rho ^{2}}{RT^{3}}}\left(1+\gamma \rho ^{2}\right)\exp \left(-\gamma \rho ^{2}\right)}
Starling [ 12]
Z
=
1
+
(
B
0
−
A
0
R
T
−
C
0
R
T
3
+
D
0
R
T
4
−
E
0
R
T
5
)
ρ
+
(
b
−
a
R
T
−
d
R
T
2
)
ρ
2
+
α
(
a
R
T
+
d
R
T
2
)
ρ
5
+
c
ρ
2
R
T
3
(
1
+
γ
ρ
2
)
exp
(
−
γ
ρ
2
)
{\displaystyle Z=1+\left(B_{0}-{\frac {A_{0}}{RT}}-{\frac {C_{0}}{RT^{3}}}+{\frac {D_{0}}{RT^{4}}}-{\frac {E_{0}}{RT^{5}}}\right)\rho +\left(b-{\frac {a}{RT}}-{\frac {d}{RT^{2}}}\right)\rho ^{2}+\alpha \left({\frac {a}{RT}}+{\frac {d}{RT^{2}}}\right)\rho ^{5}+{\frac {c\rho ^{2}}{RT^{3}}}\left(1+\gamma \rho ^{2}\right)\exp \left(-\gamma \rho ^{2}\right)}
右图是根据Starling的減縮温度與第二和第三減縮维里系数的曲线:
根据Starling減縮温度与減縮第二和第三维里系数。 最后两个方程中的指数项是令人意外的,而且不合乎维里级数序列。然而,随着ρ增加,這指数项收敛得非常快,如果我们在它的泰勒级数序列中仅取前两项
1
−
γ
ρ
2
{\displaystyle 1-\gamma \rho ^{2}}
1
+
γ
ρ
2
{\displaystyle 1+\gamma \rho ^{2}}
1
−
γ
2
ρ
4
{\displaystyle 1-\gamma ^{2}\rho ^{4}}
c
/
R
T
3
{\displaystyle c/RT^{3}}
取代了指数项后,Benedict-Webb-Rubin與Starling方程有这种有趣的形式:
Z
=
1
+
b
ρ
r
+
c
ρ
r
2
+
f
ρ
r
5
{\displaystyle Z=1+b\rho _{r}+c\rho _{r}^{2}+f\rho _{r}^{5}}
第四和第五维里系数为零。在第三维里项之后,下一个重要项是第六维里项。看起来,前三个维里项主导了流体的压缩系数,温度范围降至
0.5
T
c
{\displaystyle 0.5T_{c}}
2.0
ρ
c
{\displaystyle 2.0\rho _{c}}
还有一点值得注意的是,在1901年的昂内斯的原始研究中,他認為第四维里系数D=0,并将更高项聚集为其维里方程中的一个残餘值。然而,第三维里系数的物理意义从未被充分认识,并且它对气液平衡的影响,被其他较高维里系数所掩盖,這是"多变量优化算法"的重要缺失。
现在我们可以了解为什么Benedict-Webb-Rubin在Beattie-Bridgeman状态方程中增加复杂的指数项。 他们认识到气相中的第三维里系数很小,但在液相中必须加大。他们没有加大第三维里系数,而是添加这个奇怪的指数项,但是其唯一目的是使第三维里系数在低温度下加大。 这个指数项的泰勒级数揭示了他们的真实意图。
重新分析Starling的数据,维里系数最好的表示公式是:
b
=
b
0
+
b
1
t
r
+
b
2
t
r
2
+
b
3
t
r
3
{\displaystyle b=b_{0}+{\frac {b_{1}}{t_{r}}}+{\frac {b_{2}}{t_{r}^{2}}}+{\frac {b_{3}}{t_{r}^{3}}}}
c
=
c
0
+
c
1
t
r
+
c
2
t
r
2
+
c
3
t
r
3
:
{\displaystyle c=c_{0}+{\frac {c_{1}}{t_{r}}}+{\frac {c_{2}}{t_{r}^{2}}}+{\frac {c_{3}}{t_{r}^{3}}}:}
f
=
f
0
+
f
1
t
r
{\displaystyle f=f_{0}+{\frac {f_{1}}{t_{r}}}}
使用简单的二阶回归分析法來分析实验的PρT等温线,可以确定b和c。然后可以使用三阶回归法分析b和c来确定
b
0
−
b
3
{\displaystyle b_{0}-b_{3}}
c
0
−
c
3
{\displaystyle c_{0}-c_{3}}
f
0
−
f
1
{\displaystyle f_{0}-f_{1}}
Fluid
b
0
{\displaystyle b_{0}}
b
1
{\displaystyle b_{1}}
b
2
{\displaystyle b_{2}}
b
3
{\displaystyle b_{3}}
c
0
{\displaystyle c_{0}}
c
1
{\displaystyle c_{1}}
c
2
{\displaystyle c_{2}}
c
3
{\displaystyle c_{3}}
f
0
{\displaystyle f_{0}}
f
1
{\displaystyle f_{1}}
Methane
0.440
-1.171
-0.236
-0.210
0.364
-0.275
-0.014
0.396
0.0319
1.71E-03
Ethane
0.330
-0.806
-0.363
-0.378
0.553
-0.675
-0.038
0.680
0.0461
2.63E-03
Propanr
0.288
-0.706
-0.245
-0.575
0.532
-0.546
-0.308
0.843
0.0334
1.89E-02
n-butane
0.377
-0.916
-0.115
-0.610
0.547
-0.519
-0.347
0.871
0.0305
2.04E-02
i-butane
0.438
-1.051
-0.172
-0.401
0.483
-0.342
-0.021
0.538
0.0194
1.19E-03
n-pentane
0.481
-1.056
-0.166
-0.560
0.668
-0.720
-0.204
0.841
0.0411
1.17E-02
i-pentane
0.242
-0.674
-0.306
-0.520
0.815
-0.943
-0.194
0.868
0.0484
9.99E-03
n-heane
0.435
-0.636
-0.358
-0.759
0.848
-1.275
-0.105
1.120
0.0604
4.98E-03
n-heptane
0.493
-0.798
-0.636
-0.428
0.589
-0.738
-0.017
0.814
0.0508
1.21E-03
n-octane
0.600
-0.744
-0.456
-0.763
0.174
-0.197
-0.272
0.919
0.0144
1.99E-02
nitrogen
0.502
-1.380
0.092
-0.333
0.400
-0.276
-0.027
0.322
0.0279
2.72E-03
CO2
0.178
-0.044
-1.517
0.039
0.428
-0.422
-0.008
0.687
0.0490
9.52E-04
H2S
0.191
-0.927
-0.078
-0.366
1.093
-1.227
-0.001
0.577
0.0578
8.37E-05
去除了维里方程的最后的余值项,这个这是非常有趣而且相当准确的三次维里方程:
Z
=
1
+
B
ρ
+
C
ρ
2
{\displaystyle Z=1+B\rho +C\rho ^{2}}
它具有凡得瓦方程式 所有最好的属性,但是没有在v = b时的無限發散性。理论上,第二维里系数代表双分子吸引力,第三个维里项表示紧密接触的三个分子之间的排斥力。直观地,我们期望B在低温下变为负值,而C将保持正值以抵消B的影响,并且因此当ρ增加时,Z及压力都持續增高。
如前所述,这种三次维里方程具有范德瓦尔斯方程的所有属性,而在v = b时没有發散性。在临界状态下, B和C系数可以利用臨界条件計算出來:
d
P
d
v
=
0
{\displaystyle {\frac {dP}{dv}}=0}
d
2
P
d
v
2
=
0
{\displaystyle {\frac {d^{2}P}{dv^{2}}}=0}
三次维里方程可以解出:
B
=
−
v
c
{\displaystyle B=-v_{c}}
C
=
v
c
2
3
{\displaystyle C={\frac {v_{c}^{2}}{3}}}
Z
c
=
P
c
v
c
R
T
c
=
1
/
3
{\displaystyle Z_{c}={\frac {P_{c}v_{c}}{RT_{c}}}=1/3}
Z
c
{\displaystyle Z_{c}}
在临界点和三相点之间是流体的饱和区域。在此区域,气相在饱和压力
P
s
a
t
{\displaystyle P_{sat}}
T
s
a
t
{\displaystyle T_{sat}}
v
l
{\displaystyle v_{l}}
v
g
{\displaystyle v_{g}}
ρ
l
{\displaystyle \rho _{l}}
ρ
g
{\displaystyle \rho _{g}}
一个正確的状态方程必须产生一个等溫線,它在
T
s
a
t
{\displaystyle T_{sat}}
v
l
{\displaystyle v_{l}}
P
s
a
t
{\displaystyle P_{sat}}
P
s
a
t
{\displaystyle P_{sat}}
T
s
a
t
{\displaystyle T_{sat}}
T
s
a
t
{\displaystyle T_{sat}}
P
s
a
t
{\displaystyle P_{sat}}
P
s
a
t
=
R
T
s
a
t
(
1
+
B
ρ
+
C
ρ
2
)
ρ
{\displaystyle P_{sat}=RT_{sat}\left(1+B\rho +C\rho ^{2}\right)\rho }
它可以重新排列为:
1
−
R
T
s
a
t
P
s
a
t
(
1
+
B
ρ
+
C
ρ
2
)
ρ
=
0
{\displaystyle 1-{\frac {RT_{sat}}{P_{sat}}}\left(1+B\rho +C\rho ^{2}\right)\rho =0}
R
T
s
a
t
/
P
s
a
t
{\displaystyle RT_{sat}/P_{sat}}
v
i
d
e
a
l
=
R
T
s
a
t
P
s
a
t
{\displaystyle v_{ideal}={\frac {RT_{sat}}{P_{sat}}}}
在饱和区域中,三次方程有三个根,可以写为:
(
1
−
v
l
ρ
)
(
1
−
v
m
ρ
)
(
1
−
v
g
ρ
)
=
0
{\displaystyle \left(1-v_{l}\rho \right)\left(1-v_{m}\rho \right)\left(1-v_{g}\rho \right)=0}
扩展为:
1
−
(
v
l
+
v
g
+
v
m
)
ρ
+
(
v
l
v
g
+
v
g
v
m
+
v
m
v
l
)
ρ
2
−
v
l
v
g
v
m
ρ
3
=
0
{\displaystyle 1-\left(v_{l}+v_{g}+v_{m}\right)\rho +\left(v_{l}v_{g}+v_{g}v_{m}+v_{m}v_{l}\right)\rho ^{2}-v_{l}v_{g}v_{m}\rho ^{3}=0}
v
m
{\displaystyle v_{m}}
v
l
{\displaystyle v_{l}}
v
g
{\displaystyle v_{g}}
v
m
{\displaystyle v_{m}}
v
m
=
v
i
d
e
a
l
−
v
l
−
v
g
{\displaystyle v_{m}=v_{ideal}-v_{l}-v_{g}}
从二次方项可以解出B:
B
=
−
(
v
l
v
g
+
v
g
v
m
+
v
m
v
l
)
v
i
d
e
a
l
{\displaystyle B=-{\frac {\left(v_{l}v_{g}+v_{g}v_{m}+v_{m}v_{l}\right)}{v_{ideal}}}}
从三次方项C可以解出C:
C
=
v
l
v
g
v
m
v
i
d
e
a
l
{\displaystyle C={\frac {v_{l}v_{g}v_{m}}{v_{ideal}}}}
由于许多流体都有
v
l
{\displaystyle v_{l}}
v
g
{\displaystyle v_{g}}
P
s
a
t
{\displaystyle P_{sat}}
T
s
a
t
{\displaystyle T_{sat}}
v
g
{\displaystyle v_{g}}
v
i
d
e
a
l
{\displaystyle v_{ideal}}
v
g
{\displaystyle v_{g}}
P
s
a
t
{\displaystyle P_{sat}}
v
g
{\displaystyle v_{g}}
P
s
a
t
{\displaystyle P_{sat}}
三次维里状态方程精确地表示从临界点到三相点的大部分物质的气液二相平衡,在三相点处固相开始出现。将此状态方程扩展到气液固体三相平衡是一件简单的事情:
P
=
R
T
V
(
1
+
B
V
+
C
V
2
+
U
V
n
+
W
V
2
n
)
{\displaystyle P={\frac {RT}{V}}\left(1+{\frac {B}{V}}+{\frac {C}{V^{2}}}+{\frac {U}{V^{n}}}+{\frac {W}{V^{2n}}}\right)}
在此维里方程中,第一项的
R
T
V
{\displaystyle {\frac {RT}{V}}}
R
T
V
2
{\displaystyle {\frac {RT}{V^{2}}}}
R
T
C
V
3
{\displaystyle {\frac {RTC}{V^{3}}}}
现在,如果我们有一项
R
T
U
V
n
{\displaystyle {\frac {RTU}{V^{n}}}}
R
T
W
V
2
n
{\displaystyle {\frac {RTW}{V^{2n}}}}
[ 13]
氩气可以用来评估气体固体三相平衡的维里方程。所有的PVT变量都除以各自的临界值,而成为无单位的纯数值。依照对应状态原理(the principle of corresponding states),所有的结果将适用于其他流体。氩气的相关数据总结在下表中:
物理性质
数值
临界点相对值
临界点体积(
d
m
3
{\displaystyle dm^{3}}
0.07459
1
临界点温度(K)
150.687
1
临界点压力(MPa)
4.863
1
临界压缩系数
0.291
0.291
三相点气体体积(
d
m
3
{\displaystyle dm^{3}}
9.853
132.1
三相点液体体积(
d
m
3
{\displaystyle dm^{3}}
0.0282
0.378
三相点固体体积(
d
m
3
{\displaystyle dm^{3}}
0.246
0.330
三相点温度(K)
83.8058
0.553
三相点压力(MPa)
0.06889
0.0142
当P,V和T以其临界相对值,
p
=
P
P
c
{\displaystyle p={\frac {P}{P_{c}}}}
v
=
V
V
c
{\displaystyle v={\frac {V}{V_{c}}}}
t
=
T
T
c
{\displaystyle t={\frac {T}{T_{c}}}}
p
=
t
v
Z
c
(
1
−
b
v
+
c
v
2
−
(
v
u
v
)
n
+
(
v
w
v
)
2
n
)
{\displaystyle p={\frac {t}{vZ_{c}}}\left(1-{\frac {b}{v}}+{\frac {c}{v^{2}}}-\left({\frac {v_{u}}{v}}\right)^{n}+\left({\frac {v_{w}}{v}}\right)^{2n}\right)}
其中
Z
c
=
P
c
V
c
R
T
c
{\displaystyle Z_{c}={\frac {P_{c}V_{c}}{RT_{c}}}}
b
=
B
V
c
{\displaystyle b={\frac {B}{V_{c}}}}
c
=
C
V
c
2
{\displaystyle c={\frac {C}{V_{c}^{2}}}}
U
=
v
u
n
{\displaystyle U=v_{u}^{n}}
W
=
v
w
2
n
{\displaystyle W=v_{w}^{2n}}
V
w
{\displaystyle V_{w}}
v
u
{\displaystyle v_{u}}
v
w
{\displaystyle v_{w}}
v
u
{\displaystyle v_{u}}
为了在氩气中产生固相,指数值n必须非常大,大于20;否则,PVT等温线不会在液体和固体之间弯曲成S形,最好的估计值是n = 30,
t
t
=
0.553
{\displaystyle t_{t}=0.553}
v
w
=
0.335
{\displaystyle v_{w}=0.335}
v
u
=
0.3443
{\displaystyle v_{u}=0.3443}
p
1
=
t
t
v
Z
c
(
1
−
b
v
+
c
v
2
)
{\displaystyle p_{1}={\frac {t_{t}}{vZ_{c}}}\left(1-{\frac {b}{v}}+{\frac {c}{v^{2}}}\right)}
p
2
=
t
t
v
Z
c
(
v
u
v
)
n
{\displaystyle p_{2}={\frac {t_{t}}{vZ_{c}}}\left({\frac {v_{u}}{v}}\right)^{n}}
p
=
t
t
v
Z
c
(
v
w
v
)
2
n
{\displaystyle p={\frac {t_{t}}{vZ_{c}}}\left({\frac {v_{w}}{v}}\right)^{2n}}
p
=
p
1
−
p
2
+
p
3
{\displaystyle p=p_{1}-p_{2}+p_{3}}
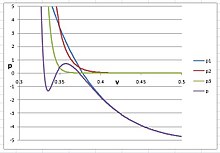
氩的PVT 等温线,n=30 在这个图中,
p
1
{\displaystyle p_{1}}
p
2
{\displaystyle p_{2}}
(
v
u
v
)
n
{\displaystyle \left({\frac {v_{u}}{v}}\right)^{n}}
p
3
{\displaystyle p_{3}}
(
v
w
v
)
2
n
{\displaystyle \left({\frac {v_{w}}{v}}\right)^{2n}}
p
2
{\displaystyle p_{2}}
p
1
{\displaystyle p_{1}}
令人惊讶的是n必须大于20才可能产生固相。我们知道Lenard-Jones的位能曲线用于量子力学原理以计算第二维里系数。量子力学认为第二维里系数是因双分子吸引力产生,第三系数是因三分子排斥力产生。在氩的液相中,一个原子有12个最近的邻原子,并且有多达32个次近邻原子。在固相中,所有原子都被锁定在结晶格子中,相互作用邻原子的数量是无限的。因此,n = 30甚至更大,是完全合理的,尽管令人惊讶。
在热力学的历史上,我们第一次有维里状态方程式,来准确地描述氩的气液固三相平衡。依照对照状态原则,在三相点所有流体都共有下列的维里方程:
p
=
t
t
v
Z
c
(
1
−
3.424
v
+
1.152
v
2
−
(
0.3443
v
)
30
+
(
0.3350
v
)
60
)
{\displaystyle p={\frac {t_{t}}{vZ_{c}}}\left(1-{\frac {3.424}{v}}+{\frac {1.152}{v^{2}}}-\left({\frac {0.3443}{v}}\right)^{30}+\left({\frac {0.3350}{v}}\right)^{60}\right)}
随着计算机的进步,维里状态方程被大量用来表示众多PρT数据,而不需要深究维里系数的物理意义。从Benedict-Webb-Rubin和Starling的状态方程来看,最好的维里状态方程可以确定是:
Z
=
1
+
b
ρ
r
+
c
ρ
r
2
+
f
ρ
r
5
{\displaystyle Z=1+b\rho _{r}+c\rho _{r}^{2}+f\rho _{r}^{5}}
^ Kamerlingh Onnes H., Expression of state of gases and liquids by means of series, KNAW Proceedings, 4, 1901-1902, Amsterdam, 125-147 (1902).
^ Dymond J. D., Wilhoit R. C., Virial coefficients of pure gases and mixtures, Springer (2003).
^ Dymond J. H., Smith E. B., Virial coefficients of pure gases and mixtures. A critical compilation, Oxford University Press, 1st Edition (1969), 2nd Edition (1980).
^ Lemmon, E.W., Huber, M.L., McLinden, M.O. NIST Standard Reference Database 23: Reference Fluid Thermodynamic and Transport Properties-REFPROP, Version 8.0, National Institute of Standards and Technology, Standard Reference Data Program: Gaithersburg, MD, (2007).
^ Van der Waals J. D., On the continuity of the gaseous and liquid states (Doctoral dissertation). Universiteit Leiden (1873).
^ Dieterici(7), C. Dieterici, Ann. Phys. Chem. Wiedemanns Ann. 69, 685 (1899).
^ D. Berthelot, D., in Travaux et Mémoires du Bureau international des Poids et Mesures – Tome XIII (Paris: Gauthier-Villars, 1907).
^ Redlich, Otto; Kwong, J. N. S. On The Thermodynamics of Solutions, Chem. Rev. 44 (1): 233–244 (1949).
^ Peng, D. Y.; Robinson, D. B., A New Two-Constant Equation of State. Industrial and Engineering Chemistry: Fundamentals. 15: 59–64 (1976).
^ Beattie, J. A., and Bridgeman, O. C., A new equation of state for fluids, Proc. Am. Acad. Art Sci., 63, 229-308 (1928).
^ Benedict, Manson; Webb, George B.; Rubin, Louis C., An Empirical Equation for Thermodynamic Properties of Light Hydrocarbons and Their Mixtures: I. Methane, Ethane, Propane, and n-Butane, Journal of Chemical Physics, 8 (4): 334–345 (1940).
^ Starling, Kenneth E., Fluid Properties for Light Petroleum Systems, Gulf Publishing Company, p. 270 (1973).
^ Ting C. H., Chen C., Chen S., The gas-liquid-solid equilibrium studied by a simple equation of state, J. Chung Cheng Inst. Tech., Vol 3, No. 1, 77-84 (1972).