施密特反应 (Schmidt反应 )是一个有机 重排反应 ,原料在叠氮酸 作用下,放出氮气 ,发生烷基 迁移生成新的C-N键。[ 1] 羧酸 作原料时,经由异氰酸酯 中间体,产物为少一个碳的胺 :
羧酸发生Schmidt反应 以酮 作原料时,产物为相同碳数的酰胺 :
酮发生Schmidt反应 醛 也可发生反应,反应后得到同碳数的腈 ,不放出二氧化碳 。
反应由卡尔·弗里德里希·施密特 (1887-1971)在1924年发现,[ 2] 质子酸 (如硫酸 、多聚磷酸 、三氯乙酸 )或路易斯酸 催化,用于合成 新的有机化合物,如2-奎宁环酮 。
如果原料在酸中稳定,则这个反应产率 很高,高于同类型的霍夫曼重排反应 、Lossen重排反应 及Curtius重排反应 。使用的羧酸可以是一元或二元直链脂肪羧酸、脂环族 羧酸或芳香族 羧酸。叠氮酸 及酰基叠氮均是易爆且有毒的化合物,使用时需注意安全。
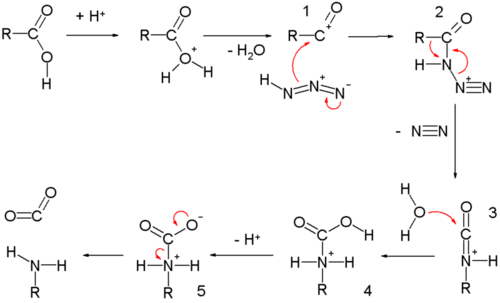
以羧酸 作原料时,首先羟基 质子化 ,水离去 ,生成酰基 阳离子1 。1 与叠氮酸 加成,生成质子化的酰基叠氮2 。2 发生重排 ,烷基R迁移至C-N键另一端,氮气离去。水进攻质子化的异氰酸酯 生成氨基甲酸酯 4 ,去质子化 及失二氧化碳 得到产物胺 。
Schmidt反应生成胺的机理 若原碳原子有手性 ,则反应后构型保持不变。除反应中间体 叠氮化物带有质子外,该反应与Curtius重排反应 颇为类似,可看作对Curtius反应的改进。
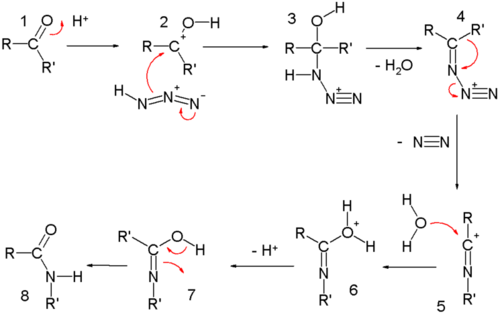
酮 作原料时的反应机理 为:羰基 加质子得到2 ,再与叠氮酸 亲核加成 生成叠氮化物中间体3 ,使羰基活化。3 发生消除反应 失水生成亚胺 4 ,而后两个烷基之一迁移至氮端,氮气离去。水进攻正电性碳,消除质子得到7 ,最后经互变异构 生成产物酰胺 。
Schmidt反应生成酰胺的机理
1955年,J.H. Boyer将该反应原料延伸至烷基 叠氮化物 R-N3 ,[ 3] 硝基 苯甲醛 与β-叠氮乙醇 的反应:
Boyer反应 对分子内 Schmidt反应的研究开始于1991年,[ 4] 双环 内酰胺 的合成:[ 5]
分子内Schmidt反应
^ Named Organic Reactions , 2nd Edition, Thomas Laue and Andreas Plagens, John Wiley & Sons: Chichester, England, New York, 2005 . 320 pp. ISBN 0-470-01041-X ^ Über den Imin-Rest; Karl Friedrich Schmidt
Ber. , 1924 , 57, 704, doi :10.1002/cber.19240570423 .
^ The Acid-catalyzed Reaction of Alkyl Azides upon Carbonyl Compounds J. H. Boyer and J. Hamer J. Am. Chem. Soc. ; 1955 ; 77(4) pp 951 - 954; doi : 10.1021/ja01609a045 ^ Intramolecular Schmidt reaction of alkyl azides Jeffrey Aube and Gregory L. Milligan J. Am. Chem. Soc. ; 1991 ; 113(23) pp 8965 - 8966; doi :10.1021/ja00023a065 ^ Cation-pi Control of Regiochemistry of Intramolecular Schmidt Reactions en Route to Bridged Bicyclic Lactams Lei Yao and Jeffrey Aubé J. Am. Chem. Soc. ; 2007 ; 129(10) pp 2766 - 2767; (Communication) doi :10.1021/ja068919r
Organic Syntheses
Organic Syntheses 2007, 84, 347-358 Article
Organic Syntheses, Coll. Vol. 10, p.207 (2004); Vol. 79, p.165 (2002). Article (页面存档备份 ,存于互联网档案馆 )
Organic Syntheses, Coll. Vol. 5, p.408 (1973); Vol. 44, p.41 (1964). Article (页面存档备份 ,存于互联网档案馆 )