|
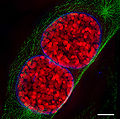
Hiển vi siêu phân giảiHiển vi siêu phân giải (Super-resolution microscopy) là một loại hiển vi quang học. Do nhiễu xạ của ánh sáng, độ phân giải của kính hiển vi quang học thông thường bị giới hạn bởi hệ thức Abbe.[1] Một cách gần đúng, độ phân giải bằng độ rộng nửa chiều cao (FWHM) của hàm mở rộng rộng điểm (point spread function - PSF). Với kính hiển vi trường sáng sử dụng vật kính có khẩu độ số lớn và ánh sáng khả kiến, độ phân giải cỡ 250 nm. Các kĩ thuật siêu phân giải cho phép thu được ảnh với độ phân giải không gian nhỏ hơn giới hạn nhiễu xạ này. Chúng có thể được chia thành hai nhóm lớn: các kĩ thuật siêu phân giải "true" và "functional" ("true" super resolution, "functional" super resolution). Các kĩ thuật "functional" dùng kĩ thuật thí nghiệm thông minh kết hợp với việc hiểu các giới hạn của đối tượng hiện ảnh để dự lại ảnh siêu phân giải.[2] Kĩ thuật siêu phân giải "true" gồm các phương pháp sử dụng siêu thấu kính Pendry (Pendry superlens), hiển vi quang học quét trường gần (near field scanning optical microscopy), hiển vi 4Pi và hiển vi chiếu sáng có cấu trúc (structured illumination optical microscopy) như SIM và SMI. Tuy nhiên, các kĩ thuật có nhiều ứng dụng trong sinh học thuộc về nhóm "functional". Các kĩ thuật siêu phân giải "functional" có thể được chia làm hai loại:[3]
Ngày 8 tháng 10 năm 2014, giải Nobel Hóa học đã được trao cho Eric Betzig, William E. Moerner và Stefan Hell vì "sự phát triển kĩ thuật hiển vi huỳnh quang siêu phân giải" và đã đưa "hiển vi quang học vào thang phân giải nano mét".[4][5] Lịch sửNăm 1978, ý tưởng lý thuyết đầu tiên đã được đưa ra nhằm phá vỡ giới hạn Abbe bằng cách sử dụng kính hiển vi 4Pi như một kính hiển vi huỳnh quang đồng tiêu quét laser.[6] Một số thông tin dưới đây được tập hợp (với sự cho phép của tác giải) từ một blog hóa học đã điểm lại các kĩ thuật hiển vi siêu phân giải Part I and Part II. Xem bài điểm ở [7] Năm 1986, bằng phát minh kính hiển vi siêu phân giải dựa trên sự phát xạ cưỡng bức đã được cấp cho Okhonin.[8] Các kĩ thuật siêu phân giải "true"Hiển vi quang học quét trường gần (Near-field scanning optical microscope - NSOM)Kĩ thuật này còn được gọi là NSOM. Kĩ thuật này dùng nguồn sáng và/hoặc đầu thu có kích thước nano mét. Sự nhiễu xạ chúng ta đã biết chỉ đúng ở trường xa: ánh sáng qua một lỗ sẽ là biến đổi Fourier của lỗ đó ở trường xa.[9] Kính hiển vi quang học quét trường gần đưa ánh sáng qua một đầu sợi quang rất nhỏ có khẩu độ (đường kính) chỉ vài chục nano mét.[10] Khi đầu sợi quang các phân tử vài nano mét, độ phân giải sẽ không còn bị giới hạn bởi nhiễu xạ mà bởi kích thước khẩu độ của đầu sợi quang. Hình ảnh hiển vi thu được bằng cách quét đầu sợi quang trên bề mặt. Điểm bất lợi chính của NSOM là sự giới hạn của số photon có thể đi qua đầu sợi quang và hiệu suất thu thấp (nếu thu huỳnh quang ở trường gần). Các kĩ thuật khác như ANSOM được đề xuất để vượt qua hạn chế này. Tăng cường cục bộ (local enhancement) / ANSOM / ăng ten quang học nanoANSOM là NSOM không sử dụng khẩu độ nhỏ: phương pháp này đưa đầu đo tới gần hạt phát quang để tăng cường trường điện từ định xứ tại vị trí của hạt.[11] Về cơ bản, đầu dò ANSOM có tác dụng như một cột thu lôi tạo ra một điểm rất sáng. Ăng ten nano Bowtie được sử dụng để tăng cường độ điện trường ở khoảng giữa hai đầu tam giác bằng vàng. Điểm này lại tăng cường cường độ điện trường cho một vùng nhỏ hơn giới hạn nhiễu xạ do đó phá vỡ được giới hạn này.[12][13] Kính hiển vi quang học dò trường gần ngẫu nhiên (Near-field optical random mapping - NORM)Hiển vi NORM là phương pháp ghi nhận trường gần bằng kính hiển vi trường xa thông qua việc theo dõi chuyển động Brownian của các hạt nano trong dung dịch.[14][15] Trên kính hiển vi, ảnh của các hạt nano là các chấm hình tròn đối xứng. Đường kính của các chấm này tương đương hàm mở rộng điểm (cỡ 250 nm) của kính hiển vi. Tọa độ trên mặt xy của chấm có thể xác định với độ chính xác cao hơn độ phân giải của kính hiển vi nhiều lần. Bằng cách thu nhiều ảnh, người ta có thể xác định phân bố cường độ của trường gần trong phạm vi quan sát của kính hiển vi. So sánh với NSOM và ANSOM, phương pháp này không yêu cầu thiết bị đặc biệt để dịch chuyển chính xác đầu dò và có trường quan sát rộng hơn cũng như độ sâu khảo sát lớn hơn. Do dùng một lượng đầu dò lớn, ảnh siêu phân giải có thể thu được trong thời gian ngắn hơn. 4PiKính hiển vi 4Pi là kính hiển vi huỳnh quang quét laser với phân giải dọc (phân giải theo độ sâu) tốt hơn. Độ phân giải dọc từ 500-700 nm được giảm xuống còn 100–150 nm, tức là vết hội tụ có dạng gần tròn với thể tích nhỏ hơn từ 5-7 lần so với vết kích thích trên kính hiển vi đồng tiêu thông thường. Kính hiển vi loại này dùng hai vật kính ngược nhau cùng hội tụ lên một vị trí. Sự khác nhau về quang trình qua mỗi vật kính được căn chỉnh sao cho nhỏ nhất. Do đó nguyên tử ở mặt phẳng tiêu chung được chiếu sáng bằng nguồn sáng kết hợp ở cả hai phía và sự phản xạ hay phát xạ cũng được thu một cách kết hợp. Góc khối dùng để chiếu sáng và thu nhận được tăng dần cho tới giá trị tối ưu. Khi đó, mẫu được chiếu và thu nhận đồng thời từ mọi phía.[16][17] Hiện nay, chất lượng tốt nhất của kính hiển vi 4Pi đạt được khi sử dụng thêm nguyên lý STED.[18] Hiển vi chiếu sáng có cấu trúc (Structured illumination microscopy - SIM) Đây cũng là một phương thức trường xa để vượt qua giới hạn nhiễu xạ.[19][20] Ý tưởng chính của phương pháp này là chiếu sáng mẫu bằng một nguồn sáng có cấu phân bố cường độ tuần hoàn và phân tích hình ảnh Moiré (Moiré pattern) thu được do sự giao thoa của cấu trúc chiếu sáng và mẫu.[21] Phương pháp này tăng độ phân giải bằng cách thực hiện biến đổi Fourier của ảnh thu được; với một số ảnh được chiếu sáng với độ dịch pha khác nhau, có thể tính toán một cách riêng rẽ và dựng lại ảnh FT với thông tin chi tiết hơn về không gian. Phép biến đổi Fourier ngược sẽ tạo ra hình ảnh siêu phân giải.
Chiếu sáng biến điệu không gian (Spatially modulated illumination - SMI) SMI sử dụng kĩ thuật làm thay đổi hàm mở rộng điểm của kính hiển vi nhằm tăng độ phân giải. Kính hiển vi Vertico SMI hoạt động theo nguyên lý sau: cường độ chiếu sáng lên mẫu không đồng nhất (ngược so với kính hiển vi huỳnh quang thông thường), mà được biến điệu theo không gian bằng cách dùng một hoặc hai chùm laser ngược nhau và cho giao thoa. Vật kính được dịch với độ chính xác cao hoặc trường sáng được dịch so với vật kính bằng bản dịch pha. Kết quả là tăng được độ sâu ảnh hiển vi và độ phân giải.[22][23][24] SMI có thể được kết hợp với các kĩ thuật siêu hiển vi khác như 3D LIMON hoặc LSI-TIRF. Kĩ thuật này đã được sử dụng để thu ảnh phân bố của phân tử tự phát quang (autofluorophore) trên các lát mô mắt người. Ba bước sóng kích khác nhau (488, 568 and 647 nm) được sử dụng cho phép thu nhận các thông tin về phổ của các phân tử tự phát quang. Kĩ thuật này cũng được sử dụng nghiên cứu mô mắt người bị thoái hòa điểm vàng AMD.[25] Các kĩ thuật "functional" tất địnhKĩ thuật RESOLFT cho phép thu ảnh hiển vi với độ phân giải cao được sử dụng trong các kính hiển vi STED[26][27] và GSD. Ngoài ra còn các phương pháp khác như sử dụng tính chất cổng quang học AND của tâm N-V (nitrogen-vacancy center).[28] Phương pháp dập tắt cưỡng bức (Stimulated emission depletion - STED) Hiển vi STED sử dụng hai laser xung, một laser kích thích phân tử phát quang, laser còn lại dập trạng thái kích thích của phân tử phát quang bằng cách bắt nó phát xạ cưỡng bức.[8][29][30][31][32][33] Trong thực tế, xung kích thích đến mẫu trước, xung STED đến sau. Laser liên tục cũng có thể được sử dụng. Thêm vào đó, xung STED được tạo hình vành khăn (ở giữa có cường độ yếu nhất) và trùng khít với vết của laser kích. Do sự phụ thuộc phi tuyến của tốc độ bức xạ cưỡng bức vào cường độ của chùm STED, tất cả các phân tử phát quang ở xung quanh tâm vết kích thích bị dập về trạng thái cơ bản - trạng thái tắt. Do đó, kích thước biểu kiến của vết kích thích giảm đi nhiều (nhỏ hơn nhiều lần giới hạn nhiễu xạ). Ảnh hiển vi thu được bằng cách quét đồng thời hai chùm laser trên mẫu. Độ rộng nửa chiều cao của vết kích thích nhỏ đi khi tăng cường độ của xung STED và tuân theo phương trình (1).
∆r là phân giải ngang, ∆ là độ rộng nửa chiều cao của PSF, Imax cường độ đỉnh của laser STED, ngưỡng dập tắt bão hòa. Hạn chế lớn nhất của hiển vi STED, cản trở nó được sử dụng rộng rãi, là hệ thiết bị rất phức tạp. Tốc độ thu ảnh khá chậm khi quan sát mẫu lớn do phải quét mẫu. Tuy nhiên với mẫu nhỏ, tốc độ có thể lên tới 80 khung/giây. [34][35] STED cần dùng laser công suất cao, do đó mẫu có thể bị hư hại. Phương pháp làm rỗng mức cơ bản (Ground state depletion - GSD)Phương pháp làm rỗng mức cơ bản dùng các mức triplet của hạt phát quang để đưa hạt vào trạng thái tối. Hạt ở trạng thái bật khi ở mức single. Việc đưa hạt từ mức singlet sang mức triplet được thực hiện bằng cách kích thích quang. Điều này tương tự như phương pháp STED, nhưng, giá trị cường độ bão hòa nhỏ hơn. So với STED, các hạt phát quang được sử dụng trong GSD nói chung kém ổn định quang hơn.[36] Hiển vi chiếu sáng bão hòa có cấu trúc (Saturated structured illumination microscopy - SSIM)SSIM khai thác sự phụ thuộc phi tuyến của tốc độ phát quang của phân tử vào cường độ laser kích.[37] Cấu trúc chùm sáng được biến điệu dạng sin với cường độ đỉnh đủ để làm bão hòa hạt phát quang. Ảnh thu được là các vân Moiré. Các vân này mang các thông tin về không gian có thể thu được bằng kĩ thuật tin học từ đó có được ảnh siêu phân giải. SSIM cần dịch cấu trúc chiếu nên bị hạn chế về tốc độ thu ảnh. Hơn nữa, phương pháp này cần phân tử bền quang do chiếu ánh sáng rất mạnh. Việc sử dụng ánh sáng mạnh có thể làm hư hại mẫu do đó cũng hạn chế khả năng ứng dụng của SSIM. SIM giúp làm tăng độ phân giải lên 2 lần. Để tiếp tục cải thiện độ phân giải, người ta thêm vào yếu tố phi tuyến để làm xuất hiện các họa ba bậc cao khi thực hiện FT. Ví dụ,[21] Gustafsson sử dụng sự bão hòa của mẫu phát quang làm hiệu ứng phi tuyến. Mỗi họa ba bậc cao cho phép một tập hợp ảnh khác có thể được sử dụng để tái dựng ảnh với độ phân giải cao hơn. Gustafsson đã thu được độ phân giải nhỏ hơn 50 nm. Các kĩ thuật "functional" ngẫu nhiênHiển vi định vị (Localization microscopy)Hiển vi định vị đơn phân tử (Single-molecule localization microscopy - SMLM) là kĩ thuật hiển vi xác định vị trí các hạt phát quang rời rạc bằng cách fit ảnh của chúng với hàm mở rộng điểm PSF. Thông thường, độ rộng của PSF (~ 250 nm) giới hạn độ phân giải. Tuy nhiên, đối với hạt rời rạc, có thể xác định vị trí của hạt với độ chính xác chỉ phụ thuộc vào cường độ phát quang của hạt theo phương trình (2).
Với Δloc là độ chính xác của phép định vị, Δ là độ rộng nửa chiều cao của PSF và N là số photon thu được. Quá trình fit chỉ thực hiện được với các hạt phát quang rời rạc, tuy nhiên, các mẫu sinh học thường được đánh dấu với mật độ phân tử phát quang cao, vì vậy không thể thực hiện định vị khi tất cả các phân tử cùng phát quang một lúc. Kĩ thuật SMLM vượt qua khó khăn này bằng cách chỉ kích hoạt một tập hợp nhỏ các phân tử đánh dấu tại một thời điểm, định vị chúng sau đó khử hoạt chúng và kích hoạt một tập hợp khác. Nói chung, kính hiển vi định vị làm việc với các phân tử phát quang. Các phân tử này phần lớn thời gian sẽ ở trạng thái tối - không phát quang. Chúng được kích hoạt sang trạng thái có thể phát quang bằng một nguồn laser công suất thấp. Một nguồn laser thứ hai kích thích các phân tử phát quang và khiến chúng bị tẩy quang hoặc chuyển về trạng thái tối, thường chỉ trong 10-100 ms. Photon huỳnh quang được ghi nhận bằng camera và tạo thành ảnh (bị mở rộng) của từng phân tử phát quang. Ảnh này có thể được fit và định vị phân tử với độ chính xác chỉ vài angstrom.[38][39] Quá trình được lặp lại hàng nghìn lần để tất cả các phân tử đều được kích hoạt và ghi ảnh. Máy tính sẽ sử dụng dữ liệu được phân tích để dựng lại ảnh siêu phân giải. Phân tử đánh dấu dùng trong phương pháp này cần có thể phát quang rất mạnh để thu được độ phân giải tốt nhất. Do đó, chúng cần hấp thụ tốt ánh sáng kích thích và có hiệu suất lượng tử cao. Chúng cũng cần có tỉ số tương phản cao (tỉ số giữa số photon phát ra khi ở trạng thái bật và tắt). Ngoài ra, mật độ đánh dấu của phải thỏa mãn tiêu chuẩn Nyquist criteria. Có nhiều loại hiển vi định vị khác nhau, được phân biệt chủ yếu dựa trên loại phân tử phát quang chúng sử dụng. Kính hiển vi định vị sử dụng phương pháp SPDM SPDM (Spectral Precision Distance Microscopy), là kĩ thuật hiển vi định vị được thực hiện lần đầu tiên vào năm 1997 cho phép xác định vị trí, khoảng cách và góc của các hạt "cô lập quang học" ("optically isolated" particles).[40][41][42] "Cô lập quang học" tức là tại một thời điểm bất kì, chỉ có một hạt phát quang trong vùng giới hạn nhiễu xạ được ghi nhận (khoảng 200–250 nm đường kính). Việc này có thể thực hiện khi các phân tử trong vùng giới hạn nhiễu xạ có phổ phát xạ khác nhau. Kính hiển vi SPDM có độ phân giải quang học lớn hơn kính hiển vi thông thường vài lần.[43] 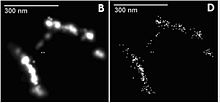 STORM, PALM and FPALMHiển vi dựng ảnh quang học ngẫu nhiên (Stochastic optical reconstruction microscopy - STORM), hiển vi định vị quang hoạt (photo activated localization microscopy - PALM) và hiển vi định vị quang hoạt huỳnh quang (fluorescence photo-activation localization microscopy - FPALM) là các kĩ thuật ảnh hiển vi siêu phân giải sử dụng phương pháp kích hoạt lần lượt các phân tử quang hoạt và định vị chúng để dựng ảnh có độ phân giải cao. Trong quá trình dựng ảnh, chỉ một tập nhỏ các phân tử được kích hoạt về trạng thái phát quang. Các phân tử này đủ phân tán để có thể phân giải được trên ảnh hiển vi huỳnh quang. Vị trí của mỗi phân tử được xác định bằng phép định tâm với độ chính xác cao. Sau đó chúng sẽ được khử hoạt và một tập khác được kích hoạt và định tâm. Quá trình này được lặp lại nhiều lần tới khí số phân tử phát quang được định vị đủ nhiều để dựng ảnh có độ phân giải cao. Ba phương pháp này được công bố độc lập trong một khoảng thời gian ngắn và có cùng nguyên lý. STORM ban đầu dùng phân tử màu Cy5 và Cy3 gắn với các axít nucleic hoặc protein,[44] PALM và FPALM dùng các protein phát quang có tính chất quang hoạt.[45][46] Về nguyên tắc, bất kì phân tử quang hoạt nào cũng có thể sử dụng được, và các loại phân tử và cách đánh dấu khác nhau đã được sử dụng trong phương pháp STORM. Bằng việc sử dụng chỉ một loại phân tử quang hoạt như Cy5,[47] STORM chỉ cần dùng một nguồn laser đỏ làm nguồn kích. Laser này đồng thời chuyển phân tử Cy5 về trạng thái tối[48][49] và sau đó quay lại trạng thái có thể phát quang. Nhiều loại chất mấu khác cũng được sử dụng cho STORM.[50][51][52][53][54][55] Ngoài ra, các cặp chất màu cũng được sử dụng. Trong cặp, một phân tử đóng vai trò hoạt tử (như Alexa 405, Cy2, và Cy3) phân tử còn lại là phân tử quang hoạt (như Cy5, Alexa 647, Cy5.5, và Cy7).[44][56][57] In this scheme, the activator fluorophore, when excited near its absorption maximum, serves to reactivate the photoswitchable dye to the fluorescent state. Multicolor imaging has been performed by using different activation wavelengths to distinguish dye-pairs based on the activator fluorophore used[56][57][58] or using spectrally distinct photoswitchable fluorophores either with or without activator fluorophores.[50][59][60] Photoswitchable fluorescent proteins can be used as well.[45][46][60][61] Highly specific labeling of biological structures with photoswitchable probes has been achieved with antibody staining,[56][57][58][62] direct conjugation of proteins,[63] and genetic encoding.[45][46][60][61] STORM has also been extended to three-dimensional imaging using optical astigmatism, in which the elliptical shape of the point spread function encodes the x, y, and z positions for samples up to several micrometers thick,[57][62] and has been demonstrated in living cells.[60] To date, the spatial resolution achieved by this technique is ~20 nm in the lateral dimensions and ~50 nm in the axial dimension and the temporal resolution is as fast as 0.1–0.33s.[cần dẫn nguồn] Tham khảo
Liên kết ngoài
|
Portal di Ensiklopedia Dunia