|
Флуоресцеїн
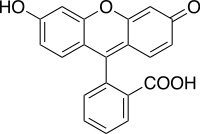
 Флуоресцеїн (англ. Fluorescein) — хімічна сполука ряду фталеїнів, синтетичний барвник помаранчевого кольору, що демонструє жовто-зелену флуоресценцію у розчинах. Гарно розчиняється в органічних розчинниках, таких як спирт. У воді у присутності основ утворює добре розчинну аніонну форму. У флуоресцентній спектроскопії використовується як стандарт при вимірюванні квантових виходів флуоресценції.[1] Численні похідні флуоресцеїну застосовуються в біохімії та клітинній біології як флуоресцентні мітки. Максимум спектру абсорбції — 494 нм, а емісії — 521 нм (у воді). Коефіцієнт екстинкції 92300 M−1см−1 (500 нм, основний етанол). Часто використовують похідні: ізотіоціанати (FITC) та 5(6)-карбоксифлуоресцеїн. Колір водного розчину — жовтий «на просвіт» або зелений «збоку». Фізичні властивостіБарвник має яскраву флуоресценцію (поглинання 494 нм / емісія 521 нм): Квантовий вихід — 50—70 %. Час життя збудженого стану варіює між 3 нс (pH < 5) i 4 нс (pH > 9). Флуоресцеїн має ізобестичну точку (однакове поглинання за різних значень pH) на 460 нм. ОтриманняВперше синтезовано Адольфом фон Баєром в 1871 році. Легко отримується сплавленням фталевого ангідриду з 1,3-дигідроксибензолом (резорцином) в присутності хлориду цинку: Застосування CH3SO3H як каталізатора дає дещо кращі виходи й м'якші умови реакції.[2][3] МеханізмПерший етап утворення барвнику — реакція Фріделя-Крафтса. При цьому кислотний каталізатор відщеплює протон, який приєднується до фталевого ангідриду, утворюючи карбокатіон — електрофіл, який заміщує гідроген в молекулі резорцину, повертаючи каталізатор. В молекулі збереглася карбонільна група, яка може знову бути протонована з утворенням карбокаіону. Далі все проходить як спочатку, а протон потім приєднується до OH-групи залишку резорцину, каталізуючи його етерифікацію з іншим залишком резорцину. Утворюється столука, яка біля центрального атома містить гідроксильну групу. Остання вступає у реакцію внутрішньомолелулярної естерифікації з утворенням лактону, який, завдяки таутомерії, частково перетворюється на забарвлену форму з хіноїдною будовою[4]: Похідні Для мічення протеїнів використовують флуоресцеїн ізотіоціанат та активовані естери карбоксифлуорисцеїну. Багато інших барвників містять скелет флуоресцеїну і додаткові замісники (скажімо сульфогрупи), що підвищують розчинність та фотостабільність. Похідними флуоресцеїну є також барвники типу еозину. ЗастосуванняСпостереження за потоками водиОдним з перших застосувань флуоресцеїну (у XIX ст.) було фарбування води в річках для відстеження напрямку потоку. Зараз подекуди застосовують для відстежень витоків трубопроводів. БіологіяУ клітинній біології флуоресцеїн та його похідні — незамінний інструмент для флуоресцентної мікроскопії. Перевагою флуоресцеїну є те, що він ідеально підходить для збудження відносно доступним аргоновим лазером (488 нм). Недоліком барвників на основі флуоресцеїну є низька фотостабільність. Див. також
Примітки
Посилання
|
||||||||||||||||||||||||||||||||||||||||||||||||||||