|
РНК-полімераза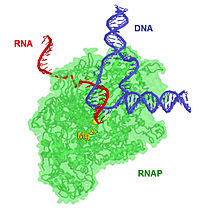 РНК-полімераза — фермент, що здійснює синтез молекул РНК. У вузькому сенсі, РНК-полімеразою зазвичай називають ДНК-залежні РНК-полімерази, що здійснюють синтез молекул РНК на матриці ДНК, тобто здійснюють транскрипцію. Ферменти класу РНК-полімераз дуже важливі для функціювання клітини, тому вони є у всіх організмах і в багатьох вірусах. Хімічно РНК-полімерази є нуклеотиділ-трансферазами, що полімеризують рибонуклеотиди на 3'-кінці ланцюжка РНК. Історія дослідженняРНК-полімераза була відкрита незалежно Семом Вайссом і Джерардом Хурвіцем в 1960 році[1]. До цього моменту Нобелівська премія з фізіології і медицини в 1959 році вже була присуджена Северо Очоа і Артуру Корнбергу за відкриття речовини, яку вважали РНК-полімеразою[2], що згодом виявилася рибонуклеазою. Нобелівська премія з хімії в 2006 році була присуджена Роджеру Корнбергу за отримання точних зображень молекул РНК-полімерази в різні моменти процесу транскрипції[3]. Керування транскрипцією Керування процесом транскрипції генів дозволяє контролювати експресію генів і таким чином дозволяє клітині адаптуватися до змін умов зовнішнього середовища, підтримувати метаболічні процеси на належному рівні, а також виконувати специфічні функції, необхідні для існування організму. Не дивно, що дія РНК-полімерази дуже складна і залежить від безлічі факторів (так, у Escherichia coli ідентифіковано більше 100 факторів, що тим або іншим способом впливають на РНК-полімеразу[4]). РНК-полімераза починає транскрипцію з особливих ділянок ДНК, які називаються промоторами, і синтезує ланцюжок РНК, комплементарний відповідній частині ланцюга ДНК. Процес нарощування молекули РНК нуклеотидами називається елонгацією. У еукаріотичних клітинах РНК-полімераза може збирати ланцюжки довжиною більше 2,4 млн елементів (наприклад, таку довжину має повний ген білка дистрофіну). РНК-полімераза завершує формування ланцюжка РНК, коли зустрічає в ДНК специфічну послідовність, що називається термінатором. РНК-полімераза синтезує такі типи РНК:
РНК-полімераза здійснює синтез з нуля. Це можливо внаслідок того, що взаємодія початкового нуклеотиду гена і РНК-полімерази дозволяє їй закріпитися на ланцюжку і приєднатись до наступних нуклеотидів. Це частково пояснює, чому РНК-полімераза зазвичай починає транксріпцию з аденіну, за яким слідує гуанін, урацил і потім цитозин. На відміну від ДНК-полімерази РНК-полімеразі притаманна також геліказна активність, що не потребує додаткових ферментів для розкручування спіралі ДНК. Дія РНК-полімеразиЗв'язування і ініціація транскрипціїВ зв'язуванні РНК-полімерази бере участь α-субодиниця, що розпізнає елемент ДНК, який передує гену (-40…-70 кроків), і σ-фактор, ділянка, що розпізнає елемент на позиціях −10…-35. Існує велика кількість σ-факторов, які контролюють експресію генів. Наприклад: σ70, який синтезується в нормальних умовах і дозволяє РНК-полімеразі зв'язуватися з генами, що відповідають за метаболічні процеси клітини; або σ32, що блокує зв'язування РНК-полімерази з генами білків теплового шоку. Після зв'язування з ДНК, структура РНК-полімерази перетворюється із закритої у відкриту. Це перетворення включає розділення моноспіралей ДНК з утворенням розкрученої ділянки довжиною близько 13 нуклеотидів. Рибонуклеотиди потім збираються в ланцюжок відповідно до базового ланцюгу ДНК, яка використовується як шаблон. Суперскрученість молекул ДНК відіграє важливу роль в активності РНК-полімерази: оскільки ділянка ДНК перед РНК-полімеразою розкручена, в ній існують позитивні компенсаційні супервитки. Ділянки ДНК позаду РНК-полімерази знову закручуються і в них присутні негативні супервитки. ЕлонгаціяПід час елонгаційної фази транскрипції відбувається додавання рибонуклеотидів до ланцюжка і перехід структури РНК-полімеразного комплексу від відкритої до транскрипційної. У міру збірки молекули РНК, ділянка ДНК перед РНК-полімеразою розкручується далі, і 13-парний відкритий комплекс перетворюється на 17-парний комплекс транскрипції. У цей момент промотор (ділянка ДНК −10…-35 нуклеотидів[джерело?]) завершується, і σ-фактор відділяється від РНК-полімерази. Це дозволяє РНК-полімеразному комплексу почати рух вперед, оскільки σ-фактор утримував його на місці. 17-парний комплекс транскрипції містить гібрид ДНК і РНК, що містить 8 пар нуклеотидів — 8-крокову ділянку РНК, сполучену з шаблонним ланцюжком ДНК. У міріу виконання транскрипції, рибонуклеотиди додаються до 3'-кінця збираної РНК, і РНК-полімеразний комплекс рухається ланцюжком ДНК. Хоча в РНК-полімеразі не виявлено властивостей, характерних для 3'-екзонуклеази, аналогічних перевірочній діяльності ДНК-полімерази, є свідоцтва того, що деякі РНК-полімерази зупиняються і коректують помилки у випадках помилкового формування пар нуклеотидів ДНК-РНК. Додавання рибонуклеотидів до РНК має механізм, дуже близький до полімеризації ДНК. Вважається, що ДНК- і РНК-полімерази можуть бути еволюційно пов'язані. Аспарагінові залишки в РНК-полімеразі зв'язуються з іонами Mg2+, які, у свою чергу, здійснюють вирівнювання фосфатних груп рибонуклеотидів: перший Mg2+ утримує α-фосфат нуклеотидтрифосфату, що підлягає додаванню в ланцюжок. Це дозволяє здійснити зв'язування нуклеотида з 3' OH-групою кінця збираного ланцюжка і таким чином додати НТФ в ланцюжок. Другий Mg2+ утримує пірофосфат НТФ. Загальне рівняння реакції таким чином має вигляд: (НМФ)n + НТФ --> (НМФ)n+1 + ПФi ТермінаціяТермінація транскрипції РНК може бути ρ-незалежною або ρ-залежною. ρ-незалежна термінація здійснюється без допомоги ρ-фактора. Транскрипція паліндромної ділянки ДНК призводить до формування шпильки з РНК, яка зациклена і зв'язана сама на себе. Ця шпилька багата на гуанін і цитозин, що робить її стабільнішою, ніж гібрид ДНК-РНК. В результаті 8-парний гібрид ДНК-РНК в комплексі транскрипції скорочується до 4-парного. У випадку, якщо ці 4 останніх пари нуклеотидів ссформовані слабкими аденіном і уридином, молекула РНК відділяється. [5]. Бактеріальна РНК-полімеразаУ бактерій один і той самий фермент каталізує синтез трьох типів РНК: мРНК, рРНК і тРНК. РНК-полімераза — чимала молекула. Основний фермент містить 5 субодиниць (~400 кДа):
Для зв'язування з промоторними областями ДНК, основний фермент потребує ще одну субодиницю — сігма (σ). Сігма-фактор значно знижує спорідненість РНК-полімерази до неспецифічних областей ДНК, і в той же час підвищує її чутливість до певних промоторів, залежно від своєї структури. З його допомогою транскрипція починається з потрібної ділянки ДНК. Повний голофермент таким чином складається з 6 субодиниць: α2ββ'σω (~480 кДа). У структурі РНК-полімерази присутня канавка 55 Å завдовжки (5,5 нм) і 25 Å завширшки (2,5 нм). Саме у цю канавку поміщається подвійна спіраль ДНК, що має ширину 20 Å (2 нм). На довжині канавки укладається 16 нуклеотидів. Молекули РНК-полімерази не плавають вільно в цитоплазмі. Коли РНК-полімераза не використовується, вона зв'язується з неспецифічними областями ДНК в очікуванні відкриття активного промотора. Транскрипційні кофакториІснують білки, що зв'язуються з РНК-полімеразою і впливають на її поведінку. Наприклад greA і greB з E. coli підсилюють здатність РНК-полімерази розщіпляти шаблон РНК з кінця ланцюжка, що росте. Таке розщеплення може «врятувати» застряглу молекулу РНК-полімерази, а також, ймовірно, бере участь в усуненні помилок збірки ланцюга РНК. Окремий кофактор Mfd задіяний в транскрипційному відновленні ДНК. Під час цього процесу РНК-полімераза виявляє пошкоджені ділянки ДНК і привертає інші ферменти для її відновлення. Багато інших кофакторів мають регулюючий вплив, примушуючи РНК-полімеразу експресувати або не експресувати певні гени. РНК-полімераза в еукаріотичних клітинах Еукаріоти мають різні типи РНК-полімераз, що класифікуються за типами РНК, які вони синтезують:
Існують також і інші типи РНК-полімерази, що використовуються в мітохондріях і хлоропластах. РНК-полімераза у архейАрхеї використовують один вид РНК-полімерази, який проте дуже схожий на три основні типи РНК-полімераз у еукаріотів. Деякі вчені припускають, що архейна РНК-полімераза в певному наближенні може бути еволюційним предком спеціалізованих еукаріотичних полімераз[9]. РНК-полімераза у вірусів Багато вірусів містять РНК-полімеразу. Мабуть, найкраще вивчена вірусна РНК-полімераза бактеріофагу Т7. Ця РНК-полімераза, що складається з однієї субодиниці, схожа на мітохондріальну і хлоропластну, а також на ДНК-полімеразу[10]. Вважається, що більшість вірусних полімераз походять від ДНК-полімерази, а не від складних багатокомпонентних РНК-полімераз. Вірусні полімерази дуже різноманітні. Деякі з них можуть використовувати як шаблон РНК, а не ДНК, як, наприклад, у вірусів з дволанцюжковою РНК або з одноланцюжковою РНК зі зворотною послідовністю. Деякі віруси з одноланцюжковою РНК з прямою послідовністю також містять РНК-залежні РНК-полімерази[11]. Функціональні областіC'-кінцевий домен РНК-полімеразиІніціювання транскрипціїДомен, розташований на карбоксильному кінці РНК-полімерази II здійснює ініціацію транскрипції ДНК. C'-кінцевий домен зазвичай складається з порядка 52 повторення послідовності Tyr-Ser-Pro-Thr-Ser-Pro-Ser[12]. Фактор транскрипції TFIIH, що є кіназою, гіперфосфорилюрує C'-кінцевий домен РНК-полімерази, тим самим примушуючи полімеразний комплекс почати рух від місця ініціації транскрипції. 5'-кеппінгДомен карбоксильного кінця також є місцем зв'язування з комплексом кеп-синтезу і кеп-зв'язування. У еукаріотів після збірки 5'-кінця РНК, кеп-синтезуючий комплекс відщеплює гамма-фосфат від 5'-фосфата і приєднує до нього гуанозинмонофосфат з утворенням 5',5'-трифосфатного зв'язку. Синтезуючий комплекс потім відділяється і шапочка з ГТФ зв'язується з кеп-зв'язуючим комплексом, який у свою чергу зв'язаний з C'-кінцевим доменом РНК-полімерази. Шапочка на 5'-кінці еукаріотичних РНК важлива для зв'язування молекул РНК з рибосомами або з РНК-полімеразою, а також запобігає руйнуванню РНК. СплайсосомаВуглекисло-кінцевий домен РНК-полімерази також є областю зв'язування з сплайсосомними факторами, що беруть участь в процесі сплайсингу РНК. Ці фактори сприяють здійсненню сплайсинга і видалення інтронів в процесі транскрипції РНК. Мутація в C'-кінцевому доменіПроведено ряд досліджень поведінки РНК-полімерази при видаленні визначених амінокислот з її C'-кінцевого домену. Показано, що мутації усікання C'-кінцевого домену РНК-полімерази II впливають на її здатність починати транскрипцію набору генів in vivo, знижуючи чутливість до активаційних послідовностей цих генів. Очищення РНК-полімеразиРНК-полімераза може бути виділена такими способами:
А також комбінаціями вищезгаданих методів. Див. такожПримітки
Посилання
|