|
วิตามินบี12
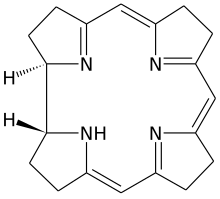  วิตามินบี12 (อังกฤษ: vitamin B12, cobalamin) เป็นวิตามินละลายน้ำได้ที่เป็นกุญแจสำคัญในการทำงานเป็นปกติของสมองกับระบบประสาท และการสร้างเม็ดเลือดแดง เป็นรูปแบบหนึ่งของวิตามินบี 8 อย่าง ที่เกี่ยวข้องกับกระบวนการเมแทบอลิซึมในเซลล์ทุกเซลล์ในร่างกายมนุษย์ โดยมีผลเฉพาะต่อการสังเคราะห์ดีเอ็นเอ เมแทบอลิซึมของกรดไขมันและกรดอะมิโน[1] ไม่มีเห็ดรา พืช หรือสัตว์ (รวมทั้งมนุษย์) ที่สามารถสร้างวิตามินบี12ได้ มีแต่สิ่งมีชีวิตประเภทแบคทีเรียและอาร์เคียที่มีเอนไซม์เพื่อสังเคราะห์มันได้ แหล่งของวิตามินที่ได้พิสูจน์แล้วเป็นผลิตภัณฑ์สัตว์รวมทั้งเนื้อ ปลา ผลิตภัณฑ์นม และอาหารเสริม แต่ก็มีงานวิจัยที่แสดงว่า ผลิตภัณฑ์ที่ไม่ใช่มาจากสัตว์บางอย่างอาจเป็นแหล่งธรรมชาติของวิตามินได้ เพราะอยู่ร่วมกับแบคทีเรีย (bacterial symbiosis) วิตามินบี12 เป็นวิตามินที่ใหญ่ที่สุด มีโครงสร้างซับซ้อนที่สุด และสามารถสังเคราะห์โดยหมักแบคทีเรีย (bacterial fermentation-synthesis) แล้วใช้เสริมอาหารและเป็นวิตามินเสริม วิตามินบี12 เป็นกลุ่มสารประกอบที่มีโครงสร้างเคมีเกี่ยวข้องกัน (หรือที่เรียกว่า vitamer) ซึ่งมีฤทธิ์ทางชีวภาพ และมีธาตุโคบอลต์ (Co) ที่ไม่สามัญทางเคมี-ชีวภาพ อยู่ตรงกลางวงแหวนเชิงระนาบแบบ tetra-pyrrole ที่เรียกว่าวงแหวน corrin (ดูรูป) ซึ่งสามารถผลิตได้โดยแบคทีเรีย hydroxocobalamin แต่ร่างกายสามารถแปรรูปแบบวิตามินไปในแบบต่าง ๆ ได้ วิตามินค้นพบโดยความสัมพันธ์ของมันกับโรคภาวะเลือดจางเหตุขาดวิตามินบี12 (pernicious anemia) ซึ่งเป็นโรคภูมิต้านตนเอง และมีผลทำลายเซลล์ผนัง (parietal cell) ที่มีหน้าที่หลั่งไกลโคโปรตีน คือ intrinsic factor ในกระเพาะอาหาร เซลล์เหล่านี้ยังมีหน้าที่หลั่งกรดย่อยอาหารในกระเพาะอีกด้วย เพราะว่า intrinsic factor จำเป็นต่อการดูดซึมวิตามินตามปกติ การขาดโปรตีนนี้เพราะโรค จึงทำให้ขาดวิตามินบี12 ยังมีรูปแบบการขาดวิตามินแบบเบากว่าอื่น ๆ ที่ผลติดตามทางชีวเคมีก็ปรากฏชัดแล้ว[2] การแพทย์วิตามินบี12 ใช้รักษาการขาดวิตามินบี12 ไซยาไนด์เป็นพิษ และการขาดวิตามินบี12โดยกรรมพันธุ์ (hereditary deficiency of transcobalamin II)[3] เป็นวิตามินที่ให้โดยเป็นส่วนของการวินิจฉัยภาวะเลือดจางเหตุขาดวิตามินบี12 (pernicious anemia) โดย Schilling test[3] สำหรับไซยาไนด์เป็นพิษ แพทย์จะให้ hydroxocobalamin ทางเส้นเลือดดำและบางครั้งพร้อมกับ sodium thiosulfate ซึ่งใช้เป็นยาแก้พิษไซยาไนต์อีกอย่างหนึ่ง[4] กลไกออกฤทธิ์ตรงไปตรงมา คือ ลิแกนด์ไฮดรอกไซด์ของ hydroxycobalamin จะแทนที่ด้วยไอออนไซยาไนด์ที่เป็นพิษ รวมกันกลายเป็นรูปแบบวิตามินบี12 ที่ไม่มีโทษและสามารถขับออกทางปัสสาวะ ในประเทศสหรัฐอเมริกา องค์การอาหารและยาปี 2549 อนุมัติให้ใช้ hydroxocobalamin เพื่อรักษาพิษของไซยาไนด์แบบฉับพลัน[5] ประมาณบริโภคอ้างอิง (DRI)ในปี 2541 คณะกรรมการอาหารและโภชนาการของสถาบันการแพทย์สหรัฐอเมริกาได้อั๊ปเดตค่าประเมินความจำเป็นโดยเฉลี่ย (Estimated Average Requirements, EARs) และค่าเผื่อทางอาหารต่อวัน (Dietary Allowances, RDAs) สำหรับวิตามินบี12 เป็น
เพื่อความปลอดภัย คณะกรรมการยังตั้งระดับบริโภคทนได้สูงสุด (Tolerable Upper Intake Levels, ULs) สำหรับวิตามินและแร่ธาตุด้วยเมื่อมีหลักฐานเพียงพอ ในกรณีวิตามินบี12 ไม่มีระดับสูงสุดเพราะยังไม่มีข้อมูลในมนุษย์ว่ามีผลลบเมื่อทานมาก และองค์การความปลอดภัยอาหารยุโรป (European Food Safety Authority) ก็ทบทวนเรื่องเดียวกันแล้วสรุปว่า ไม่มีหลักฐานเพื่อตั้งค่าสูงสุดสำหรับวิตามินบี12[6] ค่า EARs, RDAs, และ ULs เหล่านี้รวม ๆ กันเรียกว่า ปริมาณบริโภคอ้างอิง (Dietary Reference Intake)[7] ส่วนป้ายอาหารและวิตามินเสริมในสหรัฐจะแสดงค่าเป็นเปอร์เซ็นต์ที่ควรได้ต่อวัน (percent of Daily Value, %DV) สำหรับวิตามินบี12 100% ของ %DV เคยอยู่ที่ 6.0 μg แต่ตั้งแต่เดือนพฤษภาคม 2559 ได้ลดลงเหลือ 2.4 μg แหล่งจากสาหร่ายที่สร้างความขัดแย้งองค์กรต่าง ๆ (รวมทั้ง UK Vegan Society, Vegetarian Resource, และ Physicians Committee for Responsible Medicine) แนะนำผู้ทานอาหารเจแบบวีแกนให้ทานอาหารเสริมวิตามินบี12 อย่างสม่ำเสมอ หรือทานวิตามินเสริมเพื่อได้วิตามินตามที่แนะนำ[8][9][10] สำหรับผู้ที่ทานอาหารแบบวีแกนที่มีวิตามินบี12 น้อยมาก และบุคคลอื่นที่ต้องการวิตามินจากอาหารนอกจากผลิตภัณฑ์สัตว์ การทานอาหารที่ไม่มีวิตามินเทียม (pseudovitamin-B12) แต่มีวิตามินแบบมีฤทธิ์ทางชีวภาพเป็นเรื่องสำคัญ โดยวิตามินบี12 เทียมหมายถึงสารประกอบที่คล้ายกับวิตามิน แต่ไม่มีฤทธิ์ทางชีวภาพ และก็พบพร้อมกับวิตามินที่มีฤทธิ์ ทั้งในตัวมนุษย์เอง[11] ในอาหารหลายอย่าง (แม้แต่ผลิตภัณฑ์สัตว์[12]) และอาจจากวิตามินเสริมและอาหารที่เสริมวิตามิน[13] ในไซยาโนแบคทีเรียรวมทั้งสาหร่ายเกลียวทอง สาหร่ายอื่น ๆ และสาหร่ายญี่ปุ่น (Porphyra tenera หรือ Asakusa-nori) จะพบวิตามินเทียมเช่นนี้โดยมาก[14] ยังไม่มีการทดลองในมนุษย์โดยมีขนาดตัวอย่างพอเพื่อเป็นหลักฐานของฤทธิ์เอนไซม์ของวิตามินบี12 ที่มาจากแหล่งอื่นนอกจากแบคทีเรีย เช่น สาหร่ายในสกุล Chlorella และสาหร่ายทะเลที่ทานได้อื่น ๆ แม้ว่า ทางเคมีแล้ว แหล่งเหล่านี้จะรายงานว่ามีรูปแบบวิตามินที่มีโครงสร้างทางเคมีคล้าย ๆ กับวิตามินที่มีฤทธิ์[15] การขาดวิตามินบี12การขาดวิตามินบี12 อาจทำให้เสียหายอย่างรุนแรงโดยฟื้นคืนไม่ได้ โดยเฉพาะต่อสมองและระบบประสาท[16] ในระดับที่ต่ำกว่าปกติเพียงเล็กน้อย อาจมีอาการเช่นความล้า อารมณ์ซึมเศร้า และความจำไม่ดี[2] การขาดวิตามินอาจเป็นเหตุของอาการฟุ้งพล่าน (mania) หรืออาการโรคจิต (psychosis)[17][18] การขาดวิตามินบี12 เกิดจากการทานไม่พออย่างสามัญที่สุด แต่ว่าอาจเกิดจากการดูดซึมได้ไม่ดี โรคทางลำไส้บางอย่าง การมีโปรตีนยึดเหนี่ยว (binding protein) น้อย หรือเมื่อใช้ยาบางประเภท วิตามินมีน้อยมากในพืช และดังนั้น คนที่ทานเจมีโอกาสขาดวิตามินสูงสุด ทารกจะเสี่ยงขาดวิตามินสูงกว่าถ้าแม่ทานเจ ผู้สูงอายุที่จำกัดการทานผลิตภัณฑ์สัตว์เป็นกลุ่มที่เสี่ยงอีกกลุ่มหนึ่ง[19] การขาดวิตามินบี12 สามารถปรากฏเป็นภาวะเลือดจาง ในบางกรณี การขาดวิตามินอาจทำให้เสียหายอย่างถาวร มีงานศึกษาเมื่อไม่นานที่สัมพันธ์ความซึมเศร้ากับการขาดวิตามินบี12 การมีวิตามินบี12 ในระดับที่เพียงพอ ยังสัมพันธ์อย่างอิสระกับการลดความเสี่ยงต่อโรคซึมเศร้าและกับการรู้คิดที่ดีกว่าแม้เมื่อควบคุมตัวแปรกวนแล้ว[20] วิตามินเป็นซับสเตรตของปฏิกิริยาในเซลล์หลายอย่าง รวมทั้งการสังเคราะห์กรดนิวคลีอิกและสารสื่อประสาทที่อาศัยกระบวนการ methylation และการสังเคราะห์สารสื่อประสาททั้ง 3 อย่าง (รวมทั้งเซโรโทนิน นอร์เอพิเนฟริน และโดพามีน) สามารถช่วยเพิ่มผลของยาแก้ซึมเศร้าที่ใช้โดยปกติ[21] ระดับวิตามินภายในเซลล์สามารถอนุมานได้จากความเข้มข้นของ homocysteine ในเลือด ซึ่งจะเปลี่ยนเป็น methionine ผ่านปฏิกิริยาทางเอนไซม์ที่ใช้ 5-methyltetrahydrofolate เป็นตัวให้ methyl ดังนั้น ระดับ homocysteine ในลือดจะลดลงเมื่อระดับวิตามินบี12 ในเซลล์สูงขึ้น นอกจากนั้นแล้ว เพราะว่าเมแทบอไลต์ที่ออกฤทธิ์ของวิตามินจำเป็นในกระบวนการ methylation ของ homocysteine เพื่อผลิต methionine ซึ่งเป็นกรดอะมิโนที่มีบทบาทในกระบวนการทางเคมี-ชีวภาพของการสร้างและสลายสารสื่อประสาทประเภทโมโนอะมีน ดังนั้น การขาดวิตามินจึงอาจมีผลต่อการผลิตและการทำงานของสารสื่อประสาทเหล่านั้น[22] นอกจากโฮโมซิสเทอีน (homocysteine) แล้ว กรดเมทิลมาโลนิกในปัสสาวะหรือในพลาสมาก็เป็นตัวบ่งชี้ระดับวิตามินบี 12 ที่สำคัญอีกตัว ซึ่งจะเพิ่มขึ้นเมื่อขาดวิตามินบี 12[23] อย่างไรก็ตาม ระดับของกรดเมทิลมาโลนิกที่เพิ่มขึ้นอาจบ่งบอกถึงความผิดปกติของระบบเมตาบอลิซึมที่มักถูกมองข้ามก็อาจเป็นได้[24] นั่นคือภาวะกรดมาโลนิกและกรดเมทิลมาโลนิกในปัสสาวะ (Combined malonic and methylmalonic aciduria, CMAMMA)[25] แหล่งจากสัตว์วิตามินบี12 พบในผลิตภัณฑ์สัตว์โดยมาก รวมทั้งปลาและหอย เนื้อ (โดยเฉพาะตับ) ไก่ ไข่ นม และผลิตภัณฑ์นม[2] แต่การดูดซึมวิตามินจากไข่น้อยกว่า 9% เทียบกับ 40% – 60% จากปลา สัตว์ปีก และเนื้อ[26] สถาบันสุขภาพแห่งชาติสหรัฐ (NIH) ซึ่งกำหนดการได้วิตามิน 100% ต่อวันที่ 6 μg/วัน แสดงแหล่งวิตามินจากสัตว์ต่าง ๆ ดังต่อไปนี้[2]
นิตยสารชีวจิตรายงานว่าอาหารหมักดอง เช่น กะปิ น้ำปลา เต้าเจี้ยว ก็เป็นแหล่งวิตามินบี12 ด้วย[27] อาหารเสริมวิตามินอาหารที่เสริมวิตามินบี12 สามารถเป็นแหล่งวิตามินทุกวันได้ด้วย อาหารที่เสริมวิตามินบี12 อาจรวมซีเรียวอาหารเช้า ผลิตภัณฑ์ถั่วเหลือง องค์กรต่าง ๆ (รวมทั้ง UK Vegan Society, Vegetarian Resource, และ Physicians Committee for Responsible Medicine) แนะนำให้ผู้ทานอาหารเจแบบวีแกนที่ได้วิตามินจากอาหารเสริมวิตามินไม่พอให้ทานวิตามินเสริม[28][9][10] วิตามินเสริม วิตามินบี12 เป็นส่วนประกอบของวิตามินรวมและในบางประเทศ อาหารประเภทธัญพืชจะเสริมวิตามินด้วย เช่น ขนมปังและพาสตา ในสหรัฐอเมริกา ผลิตภัณฑ์ที่ไม่ต้องสั่งโดยแพทย์สามารถซื้อได้โดยมีขนาดจนถึง 5,000 µg/ต่อการรับประทาน เป็นส่วนผสมสามัญของเครื่องดื่มที่ให้กำลัง โดยปกติมีขนาดหลายเท่าจากปริมาณวิตามินที่แนะนำแต่ละวัน (RDA) ยังมีผลิตภัณฑ์ที่แพทย์ต้องสั่งไม่ว่าจะทางการฉีดหรืออื่น ๆ การดูดซึมจากใต้ลิ้นโดยตรงยังไม่มีหลักฐานว่าจำเป็นหรือมีประโยชน์ แม้ว่าจะมียาและแม้แต่วิตามินเสริมที่ทำเป็นรูปขนมอมยิ้มที่ขายสำหรับให้ดูดซึมใต้ลิ้น งานศึกษาปี 2546 ไม่พบความแตกต่างที่สำคัญในการดูดซึมเข้าเลือดระหว่างที่ทานหรือที่ "ดูดซึมใต้ลิ้น" สำหรับวิตามมิน (cobalamin) ขนาด 0.5 มก.[29] การเสริมวิตามินใต้ลิ้นมีผลก็เพียงเพราะว่ามีขนาดสูง (0.5 มก.) และในที่สุดก็ต้องกลืน ไม่ใช่เป็นอะไรที่ดีกว่ายาทาน ดังจะกล่าวต่อไป ขนาดที่สูงของยาทานอาจมีประสิทธิผลในการรักษา แม้ว่า จะมีปัญหาการดูดซึมวิตามินจากทางเดินอาหาร เช่นที่เกิดจาก กระเพาะฝ่อ (จาก pernicious anemia) การฉีดและแผ่นแนบผิวบางครั้งจะใช้ถ้ามีปัญหาการดูดซึม แต่ก็มีหลักฐานว่าวิธีเช่นนี้อาจไม่จำเป็นเพราะขนาดสูงของวิตามินที่ใช้ในปัจจุบัน (เช่น 0.5-1 มก. หรือมากกว่านั้น) แม้แต่โรค pernicious anemia เอง (ภาวะเลือดจางเหตุขาดวิตามินบี12) ก็ยังรักษาได้โดยใช้ทาน[30][31][32] คือวิตามินเช่นนี้มีขนาดสูงจนกระทั่งว่าประมาณ 1–5% ของผลึกวิตามินที่ไม่ได้ยึดกับอะไรจะดูดซึมเข้าไปในทางเดินอาหารผ่านการแพร่ที่ไม่ต้องทำอะไร (passive diffusion) แต่ว่า ถ้าคนไข้มี methyltransfer pathway (คือ cobalamin C disease, combined methylmalonic aciduria และ homocystinuria) ผิดปกติแต่กำเนิด การรักษาทางเส้นเลือด, การฉีดยา hydroxocobalamin เข้าในกล้ามเนื้อ, หรือการให้วิตามินผ่านผิวหนังอาจจำเป็น[33][34][35][36][37] วิตามินเสริมที่ไม่มีไซยาไนด์เมื่อเร็ว ๆ นี้เริ่มมีการขายวิตามิน methylcobalamin ที่ให้ทางลิ้นในขนาด 5 มก. กระบวนการเมแทบอลิซึมและการกระจายตัวของ methylcobalamin คาดว่าจะเหมือนกับรูปแบบอื่น ๆ ของวิตามินบี12[38] แม้จะไม่มีการปล่อยไซยาไนด์ แต่ว่า ปริมาณไซยาไนด์ที่ปล่อย (ที่ 20 µg สำหรับวิตามิน cyanocobalamin ขนาด 1,000 µg) จริง ๆ ก็ยังน้อยกว่าที่บริโภคจากอาหารอย่างอื่น ๆ แต่ละวัน ความปลอดภัยของวิตามินบี12ทุกรูปแบบมีหลักฐานชัดเจนแล้ว[38] แหล่งวิตามินที่ยังขัดแย้งนอกจากอาหารหมักบางอย่างแล้ว[39][40] มีพืช เห็ดรา และสาหร่าย จำนวนน้อยมากที่มีวิตามินบี12 ที่มีฤทธิ์ทางชีวภาพ และทั้งหมดเหล่านี้ไม่เคยได้ทดสอบในมนุษย์ โดยสาหร่ายเกลียวทอง (spirulina) และสาหร่ายแห้งญี่ปุ่นพันธุ์ Porphyra tenera (Asakusa-nori) พบโดยมากว่ามีแต่วิตามินบี12 เทียม ไม่ใช่เป็นวิตามินที่มีฤทธิ์ทางชีวภาพ[14][41] ระดับวิตามินบี12 สูงในเลือดการมีระดับวิตามินบี12 หรือ cobalamin สูง (คือสูงกว่า 600 pmol/L) โดยไม่ได้ทานเสริมอาจเป็นอาการของโรคที่รุนแรง แต่ว่าในกรณีเช่นนี้ เชื่อว่า วิตามินเป็นตัวบ่งโรค ไม่ใช่เหตุ เหตุอย่างหนึ่งของการมีระดับวิตามินสูงก็คือการมีโรคตับทั่วไป เนื่องจากการแยกสลายเซลล์ตับ (hepatic cytolysis) จะปล่อยวิตามินออกในเลือด และตับที่มีปัญหาจะกำจัดวิตามินได้น้อยกว่า ดังนั้น ตับอักเสบ ตับแข็ง มะเร็งเซลล์ตับ โรคตับเหตุการแพร่กระจายของเนื้อร้าย (metastatic liver disease) สามารถมาพร้อมกับระดับวิตามินที่สูงขึ้น ได้มีการเสนอว่า ระดับวิตามินบี12 ที่สูงขึ้นในเลือดเป็นตัวพยากรณ์ความเสี่ยงตายในห้องไอซียู แต่งานวิจัยปี 2557 แสดงว่า "ระดับวิตามินบี12 ที่สูงขึ้นไม่ได้เป็นตัวพยากรณ์อัตราการตายที่สำคัญหลังจากรับเข้าห้องไอซียู เมื่อควบคุมการทำงานของตับแล้ว แต่อาจเป็นตัวบ่งชี้ว่าตับทำงานได้ไม่ดี"[42] คนไข้กลุ่มสองที่ไม่ได้ทานวิตามินเสริมแต่มีระดับ cobalamin สูงมีเหตุจากการผลิตโปรตีนขนส่งวิตามินบี12 คือ haptocorrin และ transcobalamin II มากกว่าปกติ[43] ซึ่งเกิดขึ้นในโรคเลือดบางอย่าง เช่น มะเร็งเม็ดเลือดขาวเรื้อรังชนิดไมอิลอยด์ (chronic myelogeneous leukemia), มะเร็งเม็ดเลือดขาวชนิดโปรไมอิโลไซติก (promyelocytic leukemia), โพลีไซทีเมีย เวอรา, และกลุ่มอาการอีโอซิโนฟิลมากเกิน (hypereosinophilic syndrome) ระดับ cobalamin ที่สูงขึ้นยังเป็นเกณฑ์วินิจฉัยโรคสองอย่างสุดท้ายอีกด้วย คนไข้กลุ่มที่สามที่มีระดับ cobalamin สูงโดยไม่ได้เสริม (> 600 pmol/L) อาจมีความเสี่ยงสูงขึ้นต่อมะเร็งเนื่องจากสูบบุหรี่หรือดื่มสุราโดยไม่ใช่โรคเลือด (โดยมากจะได้วินิจฉัยมะเร็งภายใน 1 ปีหลังจากตรวจเจอวิตามินสูง) ในการศึกษาประชากร 333,000 คนในประเทศเดนมาร์ก คนที่มีระดับวิตามินบี12 สูงมีโอกาสเกิดมะเร็งบางอย่างสูงกว่า 3–6 เท่าของคนที่มีระดับปกติ[44] ดังนั้น งานทบทวนวรรณกรรมปี 2546 จึงอ้างว่า "โดยรวมแล้ว สามารถสรุปได้ว่าระดับ cobalamin ที่สูงขึ้นในเลือดสมควรตรวจสอบอย่างเต็มที่เพื่อประเมินว่าอาจมีโรคหรือไม่"[45] ปฏิสัมพันธ์กับสารอื่น ๆวิตามินบี12 อาจมีปฏิสัมพันธ์กับยาที่หมอสั่งต่าง ๆ[2] รวมทั้ง
โครงสร้างวิตามินบี12 มีโครงสร้างซับซ้อนที่สุดในบรรดาวิตามินทั้งหมด โดยโครงพื้นฐานเป็นวงแหวน corrin ซึ่งคล้ายกับวางแหวน porphyrin ที่พบใน heme, คลอโรฟิลล์, และ cytochrome และมีไอออนโลหะอยู่ตรงกลาง คือ โคบอลต์ จุด coordination 4/6 ของวิตามินอยู่ที่วงแหวน corrin จุดที่ 5 ที่กลุ่ม dimethylbenzimidazole ส่วนจุด coordination ที่ 6 ซึ่งเป็นศูนย์กลางปฏิกิริยา สามารถแปรได้ โดยอาจเป็นกลุ่ม cyano (-CN), กลุ่มไฮดรอกซิล (-OH), กลุ่ม methyl (-CH3), หรือกลุ่ม 5'-deoxyadenosyl ซึ่งความต่างเหล่านี้ทำให้เกิดรูปแบบของวิตามินทั้ง 4 อย่างดังจะกล่าวต่อไป โดยประวัติแล้ว พันธะโคเวเลนต์ระหว่างคาร์บอน-โคบอลต์ เป็นตัวอย่างของพันธะระหว่างคาร์บอน-โลหะแรกที่พบในชีววิทยา เอนไซม์ hydrogenase และอื่น ๆ ที่เกี่ยวข้องกับการใช้โคบอลต์ จะต้องเกี่ยวข้องในเรื่องพันธะระหว่างคาร์บอน-โลหะด้วย[51] ดังนั้น คำว่าวิตามินบี12 จึงเป็นคำทั่วไปหมายถึงโมเลกุลประกอบด้วยโคบอลต์และวงแหวน corrin ที่มีหน้าที่โดยเฉพาะในร่างกาย ซับสเตรตของโมเลกุลโคบอลต์-วงแหวน corrin ที่เป็นพื้นฐานของวิตามินบี12 แบคทีเรียต้องเป็นตัวสังเคราะห์ หลังจากการสังเคราะห์ ยกเว้นในกรณีที่มีน้อย ร่างกายมนุษย์จะสามารถเปลี่ยนรูปแบบใดแบบหนึ่งของวิตามินบี12 ไปเป็นแบบที่มีฤทธิ์ โดยใช้เอนไซม์กลุ่มพรอสเทติก (กลุ่มที่ไม่ใช่โปรตีนที่เชื่อมอยู่กับโปรตีน) ออกจากอะตอมของโคบอลต์ แล้วแทนที่มันด้วยกลุ่มอื่น รูปแบบทั้ง 4 ของวิตามินบี12 (หรือที่เรียกว่า vitamer) เป็นผลึกสีแดงเข้มเมื่อละลายน้ำ เนื่องจากสีของคอมเพล็กซ์โคบอลต์-วงแหวน corrin cyanocobalamin เป็นรูปแบบอย่างหนึ่งเช่นนี้ของวิตามินบี12 เพราะสามารถสร้างและสลายในร่างกายให้เป็น coenzyme ที่มีฤทธิ์ แต่ว่า รูปแบบนี้ไม่มีอยู่ตามธรรมชาติโดยปกติ แต่เป็นผลของรูปแบบอื่นที่ชอบเข้ายึดไซยาไนด์ เช่นเมื่อใช้ถ่านกัมมันต์ทำวิตามินที่ผลิตจากแบคทีเรียให้บริสุทธิ์ เนื่องจาก cyanocobalamin ตกผลึกง่ายและไม่ไวต่อออกซิเดชันกับอากาศ จึงมักใช้รูปแบบนี้ในการเสริมอาหารหรือในวิตามินรวมต่าง ๆ cyanocobalamin บริสุทธิ์จะมีสีชมพูเข้มที่มาจากคอมเพล็กซ์โคบอลต์รูปแปดเหลี่ยม ซึ่งมีผลึกที่ทำให้งอกได้เป็นระดับมิลลิเมตร hydroxocobalamin เป็นอีกรูปแบบหนึ่งของวิตามิน แต่ปกติจะไม่มีในร่างกายมนุษย์ และบางครั้งเรียกว่าเป็นวิตามินบี12a นี่เป็นรูปแบบที่ผลิตโดยแบคทีเรีย แต่จะเปลี่ยนเป็น cyanocobalmin เมื่อผ่านกระบวนการทำให้บริสุทธิ์โดยใช้ถ่าน hydroxocobalamin ชอบเข้ายึดกับไอออนไซยาไนด์มาก และดังนั้นจึงใช้เพื่อแก้พิษไซยาไนด์ ซึ่งมักจะผลิตเป็นรูปยาน้ำเพื่อใช้ฉีด hydroxocobalamin เชื่อว่า เปลี่ยนเป็นรูปแบบเอนไซม์ที่มีฤทธิ์ของวิตามินได้ง่ายกว่า cyanocobalamin มักจะแพงกว่า และดำรงอยู่ในร่างกายได้นานกว่า จึงมักใช้รูปแบบนี้ในกรณีที่ต้องมั่นใจว่าวิตามินจะมีฤทธิ์ การฉีด hydroxocobalamin ในกล้ามเนื้อมักใช้สำหรับเด็กที่มีปัญหาเมแทบอลิซึมกับวิตามินบี12 สำหรับผู้ขาดวิตามินที่ตามัวเพราะสูบบุหรี่ (ซึ่งเชื่อว่า บุหรี่อาจเป็นพิษให้เกิดไซยาไนด์) และสำหรับคนไข้ pernicious anemia ที่มีโรคเส้นประสาทตา (optic neuropathy) ส่วนวิตามินแบบ adenosylcobalamin (adoB12) และ methylcobalamin (MeB12) เป็นรูปแบบของ cofactor ที่มีฤทธิ์ทางเอนไซม์ และมีอยู่โดยธรรมชาติในร่างกาย ร่างกายสะสม adoB12 ไว้โดยมากในตับ ซึ่งสามารถเปลี่ยนเป็น methylcobalamin ตามต้องการ การสังเคราะห์ในการผลิตไม่มีพืชหรือสัตว์ที่สามารถสร้างวิตามินบี12 ได้โดยตนเอง[52] มีแต่สิ่งมีชีวิตแบบแบคทีเรีย และอาร์เคียเท่านั้น[53] ที่มีเอนไซม์ในการสังเคราะห์วิตามินทางชีวภาพ กระบวนการสังเคราะห์วิตามินบี12 เต็มรูปแบบรายงานเป็นครั้งแรก โดยคู่นักเคมีชาวอเมริกันและชาวสวิสในปี 2515[54][55][56] ซึ่งก็ยังคงเป็นงานคลาสสิกในเรื่องการสังเคราะห์ทางอินทรีย์ สปีชีส์จากสิ่งมีชีวิตเหล่าที่รู้ว่าสามารถสังเคราะห์วิตามินบี12 ได้คือ Acetobacterium, Aerobacter, Agrobacterium, Alcaligenes, Azotobacter, Bacillus, Clostridium, Corynebacterium, Flavobacterium, Lactobacillus, Micromonospora, Mycobacterium, Nocardia, Propionibacterium, Protaminobacter, Proteus, Pseudomonas, Rhizobium, Salmonella, Serratia, Streptomyces, Streptococcus และ Xanthomonas การผลิตวิตามินบี12 ทำโดยหมักจุลินทรีย์ที่เลือกอย่างใดอย่างหนึ่ง[57] Streptomyces griseus ซึ่งเป็นแบคทีเรียที่เคยคิดว่าเป็นยีสต์ เป็นแหล่งผลิตวิตามินบี12 หลักเป็นเวลาหลายปี[58][59] แต่ปัจจุบันมักจะใช้ Pseudomonas denitrificans และ Propionibacterium freudenreichii subsp. shermanii[60] แบคทีเรียเหล่านี้บ่อยครั้งเลี้ยงอย่างพิเศษเพื่อเพิ่มผลผลิต และบริษัทอย่างน้อยหนึ่งแห่ง (เช่น Sanofi-Aventis) ใช้แบคทีเรียที่ผ่านพันธุวิศวกรรม[61] แต่เนื่องจากว่า สปีชีส์ต่าง ๆ ของ Propionibacterium ไม่มีพิษทั้งภายในและภายนอกแบคทีเรีย และพิจารณาว่าปลอดภัยโดยทั่วไป (generally regarded as safe หรือได้สถานะ GRAS) โดยองค์การอาหารและยาสหรัฐ จึงเป็นแบคทีเรียประเภทที่องค์กรให้ความเชื่อใจมากกว่า (preferred) ในการผลิตวิตามินบี12[62] บริษัท 4 บริษัท ทั่วโลก (คือบริษัทฝรั่งเศส Sanofi-Aventis และบริษัทจีน 3 บริษัท) เชื่อว่าผลิตวิตามินบี12 รวมกันเป็นจำนวน 35 ตันในปี 2551[63] กลไกออกฤทธิ์วิตามินบี12 ทำหน้าที่เป็น coenzyme ซึ่งหมายความว่า มันจำเป็นในปฏิกิริยาทางเคมีที่เร่งโดยเอนไซม์[64][65] มีเอนไซม์ 3 กลุ่มที่ใช้วิตามินเป็น coenzyme คือ
ในมนุษย์ มีกลุ่มเอนไซม์สองกลุ่มที่ต้องอาศัยวิตามินในปฏิกิริยา 2 อย่างแรกที่กล่าว โดยมีเอนไซม์โดยเฉพาะเป็นตัวอย่างดังต่อนี้  (1) Methylmalonyl Coenzyme A mutase (MMUT) เป็นเอนไซม์แบบ isomerase ซึ่งใช้วิตามินในรูป AdoB12 และปฏิกิริยาแบบที่ 1 เพื่อเรียงโครงสร้างคาร์บอนใหม่ โดยมีกลุ่ม X เป็น -COSCoA ปฏิกิริยาของ MMUT จะเปลี่ยน methylmalonyl-CoA (MMl-CoA) เป็น succinyl-CoA (Su-CoA) ซึ่งเป็นขั้นตอนสำคัญเพื่อดึงพลังงานจากโปรตีนและไขมัน กระบวนการนี้จะพิการเมื่อขาดวิตามินบี12 โดยสามารถวัดระดับ methylmalonic acid (MMA) ที่สูงขึ้นในเลือดได้ แต่ก็น่าเสียดายว่า ระดับ MMA ที่สูงขึ้น แม้จะไวต่อการขาดวิตามินบี12 แต่ก็น่าจะไวเกิน เพราะทุกคนที่ระดับ MMA สูงไม่ได้ขาดวิตามิน ยกตัวอย่างเช่น MMA จะสูงในคนไข้ 90–98% ที่ขาดวิตามิน และคนอายุเกิน 70 ปี 20–25% จะมีระดับ MMA สูงขึ้น แต่ว่า 25–33% ไม่ได้ขาดวิตามิน เพราะเหตุนี้ การประเมินระดับ MMA เป็นปกติจึงไม่แนะนำในผู้สูงอายุ ไม่มีการทดสอบ "มาตรฐานทอง" สำหรับการขาดวิตามินบี12 เพราะว่า แม้จะเริ่มขาดวิตามิน ระดับในเลือดก็ยังอาจปกติในขณะที่การสะสมในเนื้อเยื่อค่อย ๆ พร่องลง ดังนั้น ระดับวิตามินในเลือดที่สูงกว่าเกณฑ์ต่ำสุดไม่ได้บ่งว่าไม่ขาด กระบวนการ MUT จำเป็นในการสังเคราะห์ปลอกไมอีลิน (ดูกลไกตามที่จะกล่าวต่อไป) ซึ่งโฟเลตไม่มีส่วน  (2) 5-methyltetrahydrofolate-homocysteine methyltransferase (MTR) หรือรู้จักว่า methionine synthase เป็นเอนไซม์ methyltransferase ที่ใช้วิตามินในรูปแบบ MeB12 และปฏิกิริยาแบบ 2 เพื่อย้ายกลุ่ม methyl จาก 5-methyltetrahydrofolate ไปยัง homocysteine แล้วสร้าง tetrahydrofolate (THF) และ methionine[66] ซึ่งเป็นปฏิกิริยาที่เสียไปเมื่อขาดวิตามินบี12 มีผลเป็นระดับ homocysteine ที่สูงขึ้น และเป็นโฟเลตติดกับดักอยู่ในรูป 5-methyl-tetrahydrofolate โดยไม่สามารถเปลี่ยนเป็น THF (ซึ่งเป็นโฟเลตแบบที่มีฤทธิ์) ซึ่งมีบทบาทสำคัญในการสังเคราะห์ดีเอ็นเอ และดังนั้น ระดับ THF ที่ลดลงจะทำให้ไม่สามารถสร้างเซลล์ที่ผันเวียนอย่างรวดเร็วได้อย่างมีประสิทธิภาพ โดยเฉพาะเม็ดเลือดแดงและเซลล์ผนังลำไส้ที่มีหน้าที่ดูดซึมอาหาร เพราะว่า กระบวนการ MTR สามารถสร้าง THF ใหม่ก็ได้ หรือโฟเลตใหม่อาจได้จากอาหารก็ได้ ดังนั้นผลเกี่ยวกับการสังเคราะห์ดีเอ็นเอจากการขาดวิตามินบี12 รวมทั้งภาวะเลือดจางแบบเม็ดเลือดใหญ่ (megaloblastic anemia) ซึ่งปรากฏใน pernicious anemia จะหายถ้าทานโฟเลตเพียงพอ และดังนั้น หน้าที่ที่รู้จักดีที่สุดของวิตามินบี12 (รวมทั้งการสังเคราะห์ดีเอ็นเอ การแบ่งเซลล์ และภาวะเลือดจาง) ความจริงเป็นการอำนวยให้เกิดโฟเลตในรูปแบบที่มีฤทธิ์ซึ่งจำเป็นในการผลิตดีเอ็นเอที่มีประสิทธิภาพ[67] นอกจากนั้นแล้ว เอนไซม์ย้ายกลุ่ม methyl อย่างอื่นที่จำเป็นต้องได้วิตามินบี12 เป็น coenzyme ก็ยังมีอีกในแบคทีเรีย เช่น Me-H4-MPT, coenzyme M methyltransferase หน้าที่เป็นเอนไซม์ในปฏิกิริยาทางเอนไซม์สองอย่างที่ต้องมีวิตามินบี12 ในมนุษย์ ถ้ามีโฟเลตมาก ปฏิกิริยากลุ่ม Methylmalonyl-CoA mutase (MUT) จะได้รับผลโดยตรงและข้างเคียงที่ชัดเจนที่สุด โดยมีผลต่อระบบประสาท (ดังจะกล่าวต่อไป) นี่เป็นเพราะว่า ปฏิกิริยาแบบ MTR เป็นเพียงการสร้างโฟเลตขึ้นมาใหม่ และดังนั้น จึงปรากฏชัดเจนน้อยกว่าถ้ามีโฟเลตมาก ตั้งแต่ปลายคริสต์ทศวรรษ 1990 ประเทศต่าง ๆ เริ่มเสริมโฟเลตในแป้ง ดังนั้นการขาดโฟเลตในปัจจุบันจึงน้อยลง และในเวลาเดียวกัน เนื่องจากการตรวจภาวะเลือดจาง และขนาดเม็ดเลือดแดง ที่ไวต่อปัญหาการสังเคราะห์ดีเอ็นเอ เดี๋ยวนี้ทำเป็นปกติแม้แต่ในการทดสอบทางคลินิกทั่วไป (และดังนั้น ผลทางชีวเคมีของโฟเลตบ่อยครั้งสามารถตรวจเจอได้โดยตรง) ผลของการขาดวิตามินบี12 ในกระบวนการ MTR จึงอาจไม่ปรากฏเป็นภาวะเลือดจางเหตุการสังเคราะห์ดีเอ็นเอตามที่เคยพบมาก่อน แต่ปรากฏเป็นระดับ homocysteine ที่สูงขึ้นในเลือดและในปัสสาวะ (homocysteinuria) ซึ่งชัดเจนน้อยกว่า แต่ภาวะนี้อาจมีผลเสียหายในระยะยาวต่อเส้นเลือดและการจับลิ่ม (มีผลเป็นโรคหลอดเลือดสมองและโรคหัวใจ) และผลเช่นนี้ยากที่จะจำแนกจากกระบวนการทั่วไปที่สัมพันธ์กับโรคหลอดเลือดแดงแข็งและการสูงอายุขึ้น ความเสียหายต่อปลอกไมอีลินเหตุขาดวิตามินบี12 แม้จะมีโฟเลตและ methionine เพียงพอ เป็นตัวแสดงการขาดวิตามินที่ชัดเจนโดยเฉพาะ ซึ่งสัมพันธ์กับปฏิกิริยาของวิตามินในกระบวนการ MUT ซึ่งจำเป็นอย่างขาดไม่ได้ในการเปลี่ยน methylmalonyl coenzyme A เป็น succinyl coenzyme A ความล้มเหลวของกระบวนการหลังนี้มีผลเป็นระดับที่สูงขึ้นของ methylmalonic acid (MMA) ซึ่งเป็นตัวทำปลอกไมอีลินให้เสียหาย คือ การมี MMA จะขัดขวางการสังเคราะห์กรดไขมันตามปกติ หรือว่าตัวกรดเองอาจรวมเข้ากับกรดไขมันแทนที่ malonic acid ตามปกติ และถ้ากรดไขมันที่ผิดปกตินี้กลายเป็นส่วนประกอบของปลอกไมอีลิน ปลอกก็จะเปราะ และหลุดออก (demyelination) แม้ว่ารายละเอียดของกลไกนี้ยังไม่ชัดเจนนัก แต่ผลก็คือระบบประสาทกลางหรือไขสันหลังเสื่อมแบบรวมกึ่งเฉียบพลัน (subacute combined degeneration)[68] และไม่ว่าเหตุจะคืออะไร แต่รู้อยู่แล้วว่าการขาดวิตามินบี12 มีผลเป็นโรคเส้นประสาท (neuropathies) แม้ว่า จะมีโฟเลตเพียงพอ และดังนั้น จะไม่ปรากฏภาวะเลือดจาง กระบวนการ MTR ที่อาศัยวิตามินบี12 ก็อาจทำให้เกิดผลทางประสาทเช่นกัน แม้ว่าจะโดยอ้อม เพราะว่า การมี methionine ที่เพียงพอ (และเหมือนกับโฟเลต ถ้าไม่ได้จากอาหาร ก็จะต้องสร้างใหม่จาก homocysteine ในปฏิกิริยาที่อาศัยวิตามิน) จำเป็นเพื่อจะสร้าง S-adenosyl-methionine (SAMe) ซึ่งจำเป็นในการสร้างฟอสโฟลิพิดของปลอกไมอีลิน แม้ว่าการผลิต SAMe จะไม่อาศัยวิตามิน แต่ว่า วิตามินก็ยังเป็นตัวช่วยเพื่อแปรซับสเตรตที่จำเป็น คือ methionine ให้สามารถนำไปใช้ใหม่ นอกจากนั้แล้ว SAMe ยังมีบทบาทในการผลิตสารสื่อประสาทและ catecholamines (ซึ่งเป็นส่วนประกอบของสารสื่อประสาท) บางอย่าง และเมแทบอลิซึมในสมอง สารสื่อประสาทเหล่านี้สำคัญในการดำรงอารมณ์ ซึ่งอาจอธิบายว่าทำไมโรคซึมเศร้าจึงสัมพันธ์กับการขาดวิตามินบี12 แต่ว่า การสร้างฟอสโฟลิพิดของปลอกไมอีลินก็ขึ้นอยู่กับการมีโฟเลตพอด้วย ซึ่งจะขึ้นอยู่กับกระบวนการ MTR ยกเว้นถ้าทานจากอาหารมากพอ การดูดซึมและการส่งต่อMethyl-B12 สามารถดูดซึมได้ผ่านกระบวนการสองอย่าง อย่างแรกเป็นการดูดซึมผ่านลำไส้โดยใช้ intrinsic factor ซึ่งสามารถดูดซึมได้ 1–2 ไมโครกรัมทุก ๆ 2–3 ชม. อย่างที่สองเป็นการแพร่ ซึ่งดูดซึมวิตามิน 1% ที่เหลือ[69] แต่กระบวนการทางสรีรภาพของมนุษย์เกี่ยวกับวิตามินบี12 เป็นเรื่องซับซ้อน และดังนั้น จึงง่ายที่จะมีปัญหาทำให้ขาดวิตามินบี12 เช่น วิตามินที่ยึดอยู่กับโปรตีนต้องย่อยออกจากโปรตีนก่อนโดยฤทธิ์ของเอนไซม์ protease ที่เป็นตัวย่อยทั้งในกระเพาะอาหารและในลำไส้เล็ก[70] ส่วนกรดกระเพาะอาหารเป็นตัวย่อยวิตามินออกจากตัวอาหาร ดังนั้น ยา antacid หรือขัดขวางการหลั่งกรด (โดยเฉพาะยายับยั้งการหลั่งกรด) อาจจะขัดขวางการดูดซึมวิตามินบี12 นอกจากนั้นแล้ว บางคนยังหลั่งกรดน้อยลงเมื่อสูงอายุขึ้น ซึ่งเพิ่มโอกาสขาดวิตามินด้วย[71] วิตามินบี12 เสริมแบบที่ละลายน้ำได้น้อย เคี้ยวไม่ได้ อาจจะดำเนินผ่านปากและกระเพาะโดยไม่ผสมกับกรดกระเพาะอาหารเลย แต่ว่า กรดก็ไม่จำเป็นเพื่อดูดซึมวิตามินที่ไม่ยึดกับโปรตีน ดังนั้น กรดจึงจำเป็นเพื่อจะได้วิตามินบี12 เพียงจากอาหารธรรมชาติ R-protein หรือที่เรียกว่า haptocorrin และ cobalophilin เป็นโปรตีนยึดวิตามินบี12 ที่ผลิตโดยต่อมน้ำลาย แต่มันจะต้องรอวิตามินย่อยออกจากโปรตีนในอาหารโดยเอนไซม์เพพซินในกระเพาะอาหารก่อน จากนั้น วิตามินก็จะยึดกับ R-protein เพื่อไม่ให้เสื่อมเพราะกรดในกระเพาะ[72] รูปแบบที่วิตามินบี12 ต้องยึดกับโปรตีนที่หลั่งออกในขั้นตอนการย่อยก่อน ๆ ก็จะเกิดซ้ำอีกครั้งก่อนจะดูดซึมเข้าร่างกาย โปรตีนที่จะยึดวิตามินบี12 ต่อไปก็คือ intrinsic factor (IF) ซึ่งเซลล์ผนัง (parietal cell) ของกระเพาะอาหารหลั่งออกตอบสนองต่อฮิสตามีน, gastrin, pentagastrin และ ต่อพร้อมทั้งอาหารด้วย ในลำไส้เล็กส่วนต้น เอนไซม์ protease จะย่อยบี12 ออกจาก R-protein และบี12 ก็จะเข้ายึดกับ IF กลายเป็นสารประกอบ IF/B12 บี12 จำเป็นต้องยึดกับ IF ถ้าจะดูดซึมได้อย่างมีประสิทธิภาพ เพราะว่า ตัวรับของเซลล์ enterocyte ในลำไส้เล็กส่วนปลาย (terminal ileum) รู้จักแต่สารประกอบ B12-IF นอกจากนั้นแล้ว intrinsic factor ยังป้องกันวิตามินจากกระบวนการแคแทบอลิซึมโดยแบคทีเรียในลำไส้ ดังนั้น การดูดซึมวิตามินบี12 จำเป็นต้องมีกระเพาะอาหาร, ตับอ่อน (ส่วนที่มีหน้าที่เกี่ยวกับการย่อยอาหาร), intrinsic factor (IF), และลำไส้เล็กที่ทำงานได้ ปัญหาต่ออวัยวะใดอวัยวะหนึ่งสามารถทำให้ขาดวิตามินบี12 ได้ บุคคลที่ไม่มี IF จะสามารถดูดซึมวิตามินได้น้อยลง ในโรค pernicious anemia คนไข้ไม่มี IF เนื่องจากกระเพาะอาหารอักเสบเรื้อรังแบบฝ่อเหตุภูมิต้านตนเอง (autoimmune atrophic gastritis) ที่สารภูมิต้านทาน (antibodies) เข้าทำลายเซลล์ผนัง หรืออาจจะเข้ายึดกับ IF เอง ซึ่งขัดขวางไม่ให้ IF ทำงานป้องกันบี12 เนื่องจากความซับซ้อนในการดูดซึมวิตามิน คนไข้สูงอายุ ซึ่งหลายคนจะมีกรดในกระเพาะอาหารน้อยลงเนื่องจากการทำงานของเซลล์ผนังที่ลดลง มีโอกาสเสี่ยงขาดวิตามินบี12 สูงขึ้น[73] ซึ่งทำให้ขับออกทางอุจจาระ 80–100% ของวิตามินที่ทาน เทียบกับ 30–60% ในบุคคลที่มี IF ปกติ[73] เมื่อตัวรับในลำไส้เล็กรู้จำสารประกอบ IF/B12 ได้ ก็จะช่วยขนส่งมันเข้าไปในระบบเลือด hepatic portal system ซึ่งวิตามินจะย้ายไปอยู่กับ transcobalamin II (TC-II/B12) ซึ่งทำหน้าที่เป็นตัวขนส่งวิตามินในเลือด ปัญหาทางกรรมพันธุ์ในการผลิต transcobalamins และตัวรับของมัน อาจทำให้ขาดวิตามิน, ภาวะเลือดจางแบบเม็ดเลือดโต (megaloblastic anemia), และความผิดปกติทางชีวเคมีที่เกี่ยวกับกับวิตามินบี12 ต่าง ๆ แม้ว่าอาจจะมีระดับวิตามินในเลือดที่ปกติ เพื่อที่วิตามินจะเข้าไปในเซลล์ สารประกอบ TC-II/B12 จะต้องเข้ายึดกับตัวรับของเซลล์แล้วผ่านกระบวนการนำสารเข้าสู่เซลล์ (endocytosis) โดย transcobalamin-II จะเสื่อมลงในไลโซโซมของเซลล์แล้วปล่อยบี12 ออกเข้าไปในไซโทพลาซึม ซึ่งวิตามินจะเปลี่ยนเป็น coenzyme ที่ใช้ได้ โดยอาศัยเอนไซม์ภายในเซลล์อื่น ๆ (ดังที่กล่าวมาแล้ว) งานศึกษาที่ตรวจสอบการดูดซึมวิตามินบี12 ในลำไส้ชี้ว่า ระดับการดูดซึมสูงสุดสำหรับการทานแต่ละครั้งเมื่อสถานการณ์อื่นปกติ อยู่ที่ประมาณ 1.5 µg "งานศึกษาในบุคคลปกติชี้ว่า ร่างกายจะดูดซึมประมาณ 1.5 µg ของการทานครั้งหนึ่งที่ทานเข้าไป 5–50 µg ในงานศึกษาที่คล้ายกันของ Swendseid et al อ้างว่า ระดับเฉลี่ยการดูดซึมสูงสุดอยู่ที่ 1.6 µg [...]"[74] แต่กระบวนการดูดซึมแบบแพร่ของวิตามินบี12 ดังที่กล่าวแล้ว สามารถมีมากกว่าการดูดซึมที่ต้องอาศัย R-protein และ IF เมื่อวิตามินที่ทานมีปริมาณมาก (1,000 µg หรือมากกว่านั้น) ซึ่งมักจะเกิดขึ้นในยาเสริมวิตามินที่มีแต่บี12 อย่างเดียว เป็นกระบวนการสุดท้ายนี่แหละที่ทำให้สามารถรักษา pernicious anemia และปัญหาการดูดซึมวิตามินบี12 ด้วยการให้วิตามินเสริมปริมาณมหาศาล โดยที่ไม่ต้องแก้ปัญหาการดูดซึมโดยตรง[75] วิตามินบี12 ที่สะสมในร่างกายผู้ใหญ่มีประมาณ 2–5 มก. ประมาณ 50% อยู่ในตับ แต่จะเสียไปประมาณ 0.1% ทุกวันโดยหลั่งออกในลำไส้ และวิตามินในลำไส้ไม่ได้รับการดูดซึมทั้งหมด แม้ว่า น้ำดีจะเป็นตัวหลั่งวิตามินหลัก แต่วิตามินบี12 ในน้ำดีก็สามารถนำไปใช้ใหม่ผ่านกระบวนการ enterohepatic circulation (การดูดซึมโดย Enterocyte ในลำไส้เล็กแล้วส่งไปที่ตับ) เนื่องจากประสิทธิภาพของกระบวนการนี้ ตับสามารถสะสมวิตามินบี12 ที่ใช้ได้นาน 3–5 ปี ภายใต้สภาวะและการทำงานที่ปกติ[76][77] ดังนั้น การขาดวิตามินนี้จึงค่อนข้างมีน้อย แต่ว่า อัตราการเปลี่ยนแปลงของระดับวิตามินบี12 อาจเปลี่ยนไปโดยขึ้นอยู่กับปัจจัยหลายอย่างรวมทั้งการได้จากอาหาร ปริมาณที่หลั่งออก และจำนวนที่ดูดซึมได้ การขาดวิตามินอาจเกิดขึ้นภายในปีหนึ่งถ้ามีน้อยอยู่แล้วและปัจจัยทางกรรมพันธุ์ไม่เอื้ออำนวย หรืออาจไม่เกิดเป็นทศวรรษ ๆ แต่ว่าในทารก การขาดวิตามินจะปรากฏเร็วกว่ามาก[78] ประวัติการขาดวิตามินบี12 เป็นเหตุของ pernicious anemia ซึ่งเป็นภาวะเลือดจางที่ปกติถึงชีวิตและเป็นโรคที่ไม่รู้สมุฏฐานเมื่อพบเป็นครั้งแรก วิธีการรักษาและการค้นพบวิตามินบี12 เป็นเรื่องบังเอิญ นพ. จอร์จ วิปเปิ้ล ได้ทดลองสร้างภาวะเลือดจางในสุนัขโดยเอาเลือดมันออก แล้วเลี้ยงมันด้วยอาหารต่าง ๆ เพื่อสังเกตว่าอะไรทำให้ฟื้นตัวจากภาวะเลือดจางได้เร็วที่สุด โดยวิธีนี้ เขาพบว่าการกินตับเป็นจำนวนมากดูเหมือนจะช่วยรักษาภาวะเลือดจางเนื่องจากเสียเลือดได้เร็วที่สุด ดังนั้น เขาจึงตั้งสมมติฐานว่า การทานตับอาจช่วยรักษา pernicious anemia เขาลองสมมติฐานนี้แล้วรายงานความสำเร็จในระดับหนึ่งในปี 2463 หลังจากการศึกษาทางคลินิกหลายงาน นพ. จอร์จ ไมนอต และ นพ. วิลเลียม เมอร์ฟี่ พยายามแยกสารในตับที่ช่วยรักษาภาวะเลือดจางในสุนัขแล้วพบว่ามันคือธาตุเหล็ก แต่ก็พบสารอีกอย่างหนึ่งในตับที่รักษา pernicious anemia ในมนุษย์ แต่ไม่มีผลต่อสุนัขภายใต้ภาวะของการทดลอง ดังนั้น ยาที่ใช้รักษา pernicious anemia ซึ่งพบในตับ จึงได้ค้นพบโดยบังเอิญเช่นนี้ นพ. ทั้งสองรายงานการทดลองเหล่านี้ในปี 2469 ซึ่งเป็นความก้าวหน้าแรก ๆ ในการรักษาโรคนี้ แม้จะได้ค้นพบเช่นนี้ ยังเป็นเวลาอีกหลายปีที่คนไข้ยังต้องทานตับดิบหรือดื่มน้ำตับเป็นจำนวนมาก ต่อมาปี 2471 นักเคมี ดร. เอ็ดวิน โคห์น สกัดสารจากตับที่มีฤทธิ์ 50–100 เท่ามากกว่าตับธรรมชาติ ซึ่งเป็นวิธีการรักษาโรคที่ใช้ได้จริง ๆ สำหรับผลงานเบื้องต้นที่ชี้แนวทางการรักษา นพ. ไมนอต และเมอร์ฟี่ ต่อมาจึงได้รับรางวัลโนเบลสาขาสรีรวิทยาหรือการแพทย์ปี 2477 ร่วมกัน เหตุการณ์เหล่านี้ต่อมาทำให้ค้นพบวิตามินที่ละลายน้ำได้ ซึ่งเรียกว่าวิตามินบี12 จากซุปแบคทีเรีย ในปี 2490 เมื่อทำงานอยู่ในมหาวิทยาลัยแมรี่แลนด์ ดร. แมรี่ ชอว์ ชอร์บ ในงานที่ทำร่วมกับ ดร. คาร์ล โฟลเกอร์ส แห่งบริษัทเมอร์ค ได้รับเงินทุนเพื่อพัฒนาแบบทดสอบ "LLD assay" เพื่อวิตามินบี12 โดย LLD หมายถึง Lactobacillus lactis Dorner[79] ซึ่งเป็นแบคทีเรียที่จำต้องได้สารที่เรียกว่า "LLD factor" เพื่อการเติบโต ซึ่งต่อมาระบุว่าเป็นวิตามินบี12 ดร. ชอร์บและเพื่อนร่วมงานได้ใช้ LLD assay เพื่อสกัดยาต้าน pernicious anemia จากตับ และในปี 2491 จึงสามารถสกัดวิตามินบริสุทธิ์ได้โดยได้รับการร่วมมือจาก ดร. ชอร์บ[80] ดร. คาร์ล โฟลเกอร์ส และอเล็กซานเดอร์ ทอดด์แห่งประเทศอังกฤษ เพื่อการค้นนี้ ในปี 2492 ดร. ชอร์บ และ ดร. โฟลเกอร์ส ได้รับรางวัล Mead Johnson Award จาก American Society of Nutritional Sciences[80] ดร. โดโรธี โครว์ฟุต ฮอดจ์คิน และทีมเป็นผู้กำหนดโครงสร้างทางเคมีของวิตามินในปี 2499 โดยอาศัยข้อมูลทางผลิกศาสตร์[81] ในที่สุด วิธีการผลิตวิตามินเป็นจำนวนมากจากแบคทีเรียก็พัฒนาขึ้นในช่วงคริสต์ทศวรรษ 1950 ซึ่งทำให้เกิดการรักษาโรคดังที่ทำในปัจจุบัน เชิงอรรถและอ้างอิง
แหล่งข้อมูลอื่นวิกิมีเดียคอมมอนส์มีสื่อที่เกี่ยวข้องกับ วิตามินบี12
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia
