|
Fosforečnan
Fosforečnan alebo fosfát je soľ kyseliny fosforečnej. Fosforečnanový anión má empirický vzorec PO43−. V roztoku dochádza v závislosti od pH k protonizácii fosforečnanového aniónu, takže sa môže vyskytovať ako
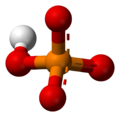
Chemické vlastnostiFosforečnanový ión má fosforový atóm obklopený štyrmi atómami kyslíka v tetraédrickom usporiadaní. Fosforečnanový ión je konjugovanou bázou hydrogénfosforečnanového iónu HPO42-, ktorý je zase konjugovanou bázou dihydrogénfosforečnanového iónu H2PO4-, ktorý je konjugovanou bázou kyseliny ortofosforečnej, H3PO4. Mnoho fosforečnanov je pri štandardnej teplote a tlaku rozpustných vo vode. Fosforečnany sodný, draselný, rubídny, cézny a amónny sú všetky rozpustné vo vode. Väčšina ostatných fosforečnanov je vo vode len málo rozpustná alebo úplne nerozpustná. Vo všeobecnosti sú hydrogénfosforečnan a dihydrogénfosforečnan o niečo lepšie rozpustné, než odpovedajúce fosforečnany. Rovnováha v roztoku Vo vodnom roztoku existuje kyselina fosforečná a jej tri anióny v rovnováhe, ktorá je daná disociačnými konštantami:[1]
Hodnoty sú udané pre 25 °C a iónovú silu I = 0. pKa hodnoty odpovedajú pH, pri ktorom je v roztoku koncentrácia zlúčeniny zhodná s jej konjugovanou bázou. Pri pH nižšom než 1 je kyselina fosforečná prakticky úplne nedisociovaná. Okolo pH 4,7 (v strede medzi prvými dvoma pKa) je prakticky jedinou prítomnou formou v roztoku. Pri pH okolo 9,8 (v strede medzi druhými dvoma pKa) je hlavnou formou HPO42-. Pri pH nad 13 existuje kyselina fosforečná ako úplne disociovaný fosforečnanový anión, PO43−. Vďaka tomu je možné kryštalizovať soli hydrogénfosforečnanov a dihydrogénfosforečnanov nastavením pH, konkrétne pri 4,7 a 9,8. Fosforečnanové anióny, H2PO4-, HPO42- a PO43−, sa chovajú ako samostatné slabé kyseliny, pretože ich pKa sa líši o viac ako 4. Fosforečnany tvoria i polymérne ióny, napríklad pyrofosfát (P2O7)4- alebo trifosfát (P3O10)5-. Rôzne metafosfátové ióny (zvyčajne ako lineárne polyméry) majú empirický vzorec (PO3)- a sú prítomné v mnohých zlúčeninách. Biochémia fosfátovV biologických systémoch sa fosfor často nachádza vo forme voľných fosfátových iónov, kde sa zvyčajne nazýva anorganický fosfát, alebo viazaný na organické molekuly v podobe organofosfátov. Anorganický fosfát sa v biochémii často zapisuje ako Pi a pri fyziologickom pH pozosáva hlavne z iónov HPO42- a H2PO4-. Pri neutrálnom pH, napríklad v cytozole (pH = 7), je pomer koncentrácií približne:
Na základe toho sú prítomné v cytozole vo významnom množstve len HPO42- a H2PO4- (38 % HPO42- a 62 % H2PO4-). V extracelulárnej tekutine (pH = 7,4) je tento pomer opačný (61 % HPO42- a 39 % H2PO4-). Anorganický fosfát môže byť prítomný i v podobe pyrofosfátu, ktorý hydrolýzou dáva ortofosfát:
Organické fosfáty sa častejšie nachádzajú v podobe esterov ako nukleotidy (napr. AMP, ADP a ATP) a v DNA a RNA. Voľný ortofosfátový anión sa uvoľňuje hydrolýzou fosfoanhydridovej väzby v ADP alebo ATP. Tieto fosforylačné a defosforylačné reakcie sú skladiskom a zdrojom chemickej energie pre mnoho metabolických procesov. ATP a ADP sa občas označujú ako vysokoenergetické fosfáty, podobne i fosfagény v svaloch. Podobné reakcie existujú i pre difosfáty a trifosfáty ostatných nukleozidov. Kosti a zubyDôležitou úlohou fosfátu v biologických systémoch je ich použitie ako štruktúrny materiál v kostiach a zuboch. Tieto štruktúry sa skladajú z fosforečnanu vápenatého vo forme hydroxyapatitu. Tvrdá zubná sklovina cicavčích zubov je tvorená fluoroapatitom, fosforečnanom hydroxyvápenatým, kde sú niektoré hydroxylové skupiny nahradené fluoridovými aniónmi. Referencie
ZdrojTento článok je čiastočný alebo úplný preklad článku Phosphate na anglickej Wikipédii. Externé odkazy
|
||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia