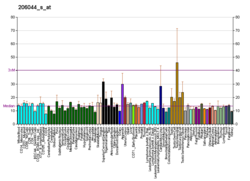
|
BRAFB-Raf («Серин/треониновая протеинкиназа B-raf»; англ. Serine/threonine-protein kinase B-raf; КФ:2.7.11.25), или c-RAF («прото-онкоген c-RAF»; англ. proto-oncogene c-RAF) — цитозольная серин/треониновая протеинкиназа семейства MAP3K[англ.]. Продукт протоонкогена B-Raf BRAF[5][6]. Киназа B-Raf участвует в формирование внутриклеточных сигналов, направленных на клеточный рост. В 2002 году мутация гена BRAF была ассоциирована с развитием рака у человека[7]. Некоторые другие мутации этого гена могут вызывать врождённые нарушения. Разработаны терапевтические агенты для лечения онкологических заболеваний, вызванных мутациями BRAF. По крайней мере два таких агента — вемурафениб[8] и дабрафениб были одобрены FDA к применению для лечения поздних стадий меланомы. Вемурафениб стал первым одобренным лекарственным агентом, разработанным на основе фрагментного дизайна лекарственных веществ. Функции Белок B-Raf - член семейства сигнальных протеинкиназ Raf. Белок играет роль в регуляции MAPK/ERK сигнальных путей, которые влияют на клеточное деление, дифференцировку и секрецию[9]. СтруктураБелок B-Raf состоит из 766 аминокислот. Молекула содержит три домена, которые характерны для белков семейства киназ Raf: структурный регион 1 (CR1), содержащий Ras-ГТФ-связывающий саморегулирующий домен[10]; структурный регион 2 (CR2), обогащённый серином шарнирный участок и структурный регион 3 (CR3), протеинкиназный каталитический участок, который способен фосфорилировать каноническую последовательность на белковом субстрате[11]. В активной конформации B-Raf формирует димер за счёт водородных и электростатических связей в киназном домене[12]. Домен CR1Домен CR1 аутоингибирует киназный домен CR3 белка и является, таким образом, скорее регулирующим, чем структурным доменом[11]. Участок белка человека 155–227[13] является Ras-ГТФ-связывающий участком, который при связывании с Ras-ГТФ, который при связывании с CR1 высвобождает последний и снимает аутоингибирование киназы. Последовательность 234–280 содержит мотив цинковый палец, который связывается с форболовым эфиром или диацилглицерином и участвует в закреплении B-Raf на клеточной мембране после связывания с Ras[13][14]. CR2Домен CR1 обеспечивает подвижное шарнирное соединение между доменами CR1 и CR3 и действует как шарнир[11]. CR3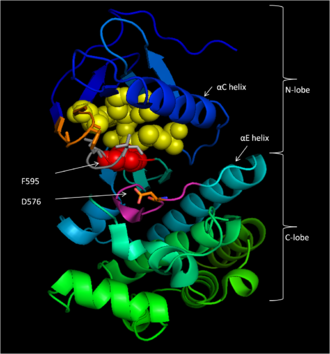 Домен CR3 (участок 457–717)[13] является ферментативным киназным доменом белка. Это исключительно консервативная структура[15], состоящая из двух долей, соединённых небольшим шарнирным участком[16]. Меньшая N-концевая доля домена (участок 457–530) отвечает в первую очередь за связывание АТФ, а большая C-концевая доля (участок 535–717) связывает белковый субстрат[15]. Активный центр фермента находится в углублении между долями и каталиатическая Аспарагиновая кислота D576 локализована на C-концевой доле и обращена внутрь междолевого углубления[13][15]. Участки домена CR3P-Петля B-Raf (участок 464–471) стабилизирует непереносящиеся фосфатные группу АТФ во время связывания фермента с АТФ. В частности серин-467, фенинлаланин-468 и глицин-469 формируют водородные связи с β-фосфатом АТФ для заякоривания молекулы АТФ. Функциональные мотивы киназного домена B-Raf были определены с помощью анализа их гомологии с протеинкиназой A[15]. Нуклеотид-связывающий пакет (V471, C532, W531, T529, L514 и A481) - гидрофобный пакет внутри которого аденин АТФ заякорен за счёт ван-дер-ваальсовых связей после связывания АТФ[15][17]. Каталитический центр включает участок 574–581, который обеспечивает перенос γ-фосфата АТФ от B-Raf на его белковый субстрат. В частности D576 действует как акцептор протона при активации нуклеофильного кислорода в гидроксильной группе серина или треонина в молекуле субстрата, что обеспечивает реакцию переноса фосфата за счёт щелочного катализа[15]. Мотив DFG включает остатки D594, F595 и G596 и является критическим мотивом B-Raf для функционирования белка как в неактивном, так и в активном состоянии. В неактивной конформации белка F595 занимает нуклеотид-связывающий пакет и предотвращает вход АТФ в пакет, снижая вероятность катализа[12][17][18]. В активной конформации D594 связывает двухвалентный катион марганца, что стабилизирует β- и γ-фосфатные группы АТФ и ориентируя γ-фосфат для переноса на субстрат[15]. Петля активации включает участок 596–600, который образует сильную гидрофобную связь с P-петлёй в неактивной конформации киназы, запирая киназу в неактивном состоянии до тех пор пока активационная петля не фосфорилирована, что дестабилизирует эти связи за счёт присутствия отрицательного заряда. Это запускает переход киназы в активное состояние. В частности, L597 и V600 активационной петли взаимодействуют с G466, F468 и V471 P-петли, что сохраняет киназный домен в неактивном состоянии до фосфорилирования киназного домена[16]. ЭнзимологияB-Raf является серино-треониновой протеинкиназой и катализирует реакцию фосфорилирования остатков серина и треонина в специфической последовательности на белках-мишенях, используя АТФ как источник фосфата, образуя на выходе реакции АДФ и фосфорилированный белок[15]. Киназа является строго регулируемым ферментом, участвующим в переносе сигнала, поэтому для того, чтобы стать активным B-Raf должен связаться с ГТФ-Ras[14]. После того как B-Raf активирован, консервативное каталитическое ядро киназы фосфорилирует белковые субстраты путём нуклеофильной атаки атома кислорода гидроксильной группы серина или треонина γ-фосфатной группой АТФ в ходе реакции бимолекулярного нуклеофильного замещения[15][19][20][21] АктивацияСнятие CR1 аутоингибированияВ нормальном неактивном состоянии киназный домен CR3 заблокирован за счёт двух механизмов: аутоингибирование собственным регуляторным доменом CR1 и отсутствием пост-трансляционного фосфорилирования ключевых серина и тирозина в шарнирном регионе CR2. Во время активации B-Raf аутоингибирующий домен CR1 связывает эффекторный домен ГТФ-Ras в своём Ras-связывающем участке и, в результате, высвобождает каталитический домен CR3. Взаимодействие CR1-Ras в дальнейшем усиливается за счёт связывания цистеин-обогащённого субдомена с Ras и фосфолипидами клеточной мембраны[11]. В отличие от A-Raf и C-Raf, домен CR2 которых должен быть фосфорилирован по определённым гидроксильным группам определённых аминокислот, в B-Raf домен CR2 постоянно фосфорилирован по S445[22]. Это позволяет отрицательно заряженному фосфосерину немедленно отдалить киназный домен CR1 за счёт стерических и электростатических взаимодействий как только регуляторный домен отсоединён, освобождая киназный домен для взаимодействия с белками-субстратами. Активация CR3После ухода аутоингибирующего регуляторного домена CR1 киназный домен CR3 должен перейти в АТФ-связанную активную конформацию. В неактивной конформации F595 в мотиве DFG блокирует гидрофобный аденин-связывающий карман, в то время как активирующая петля образует гидрофобное взаимодействие с P-петлёй, предотвращая связывание АТФ с АТФ-связывающим участком. После того, как активирующая петля фосфорилируется, отрицательный заряд фосфата дестабилизирует гидрофобное взаимодействие с P-петлёй. В результате активирующая петля меняет конформацию, вытягиваясь вдоль C-концевой доли киназного домена. В ход этого процесса она формирует взаимодействия стабилизирующего β-листа с β6-структурой. Одновременно фосфорилированный остаток подходит к лизину K507, формируя стабилизирующий солевой мостик и запирает активирующую петлю в этом положении. Мотив DFG меняет конформацию с активирующей петлёй, вызывая выход остатка F595 из аденин-связывающего участка в гидрофобный карман, расположенный рядом с альфа-спиралью. В результате этих перемещений мотива DFG и активирующей петли фосфорилирование открывает АТФ-связывающий участок. Поскольку субстрат-связывающий и каталитический участки уже находились на своём месте, фосфорилирование активирующей петли само по себе активирует киназный домен B-Raf за счёт описанной цепной реакции, которая фактически открывает крышку готового активного центра[16]. Каталитический механизм Этап 1. Хелирование двухвалентного катиона Mg остатком киназы N581 и депротонирование гидроксильной группы серина или треонина субстрата остатком киназы D576. Этап 2. Нуклеофильная атака активированной гидроксильной группы субстрата на γ-фосфатную группу АТФ. Этап 3. Комплекс с Mg распадается и D576 депротонируется. Этап 4. Выход продуктов. Для эффективного катализа фосфорилирования белка через бимолекулярный обмен остатков серина и треонина с АДФ в качестве уходящего продукта реакции B-Raf должен сначала связать АТФ, а затем стабилизировать промежуточное состояние в то время как γ-фосфат АТФ переносится[15]. Связывание АТФB-Raf связывает АТФ за счёт заякоривания аденинового нуклеотида в неполярном кармане и ориентирует АТФ за счёт водородных связей и электростатических взаимодействий с фосфатными группами. В дополнение к P-петле и мотива DFG в стабилизировании непереносящихся фосфатных групп участвуют также остатки K483 and E501. Положительный заряд первичной амино-группы остатка K483 позволяет стабилизировать отрицательный заряд на α- and β-фосфатных группах АТФ, когда АТФ связывается с киназой. В отсутствии АТФ положительный заряд нейтрализуется отрицательным зарядом карбоксильной группы E501[15][16]. ФосфорилированиеКогда АТФ связана с киназным доменом B-Raf, D576 каталитического центра фермента активирует гидроксильную группу белка-субстрата, увеличивая её нуклеофильность для запуска реакции фосфорилирования, тогда как прочие аминокислотные остатки каталитического центра стабилизируют промежуточное состояние. N581 хелатирует двухвалентный катион магния, связанного с АТФ, помогая правильной ориентировке молекулы для оптимальной реакции замены. K578 нейтрализует отрицательный заряд на γ-фосфате АТФ таким образом, что активированный субстрат не подвергается электронному отталкиванию в процессе реакции с фосфатом. После переноса фосфатной группы полученные продукты реакции АДФ и фосфопротеин высвобождаются из каталитического центра фермента[15]. ИнгибиторыПоскольку мутантные формы постоянно активной киназы B-Raf приводят к развитию раковых опухолей из-за повышенного клеточного сигнала, направленного на рост клеток, ингибиторы как неактивной, так и активной конформаций киназного домена белка были разработаны как противоопухолевые препараты[16][17][18]. Сорафениб BAY43-9006 (Сорафениб, в составе препарата Nexavar, Bayer AG) является ингибитором мутантной формы B-Raf V600E, одобренным FDA для лечения первичных злокачественных опухолей печени и почек. Ингибитор блокирует киназный домен B-Raf, запирая фермент в его неактивной форме. Ингибитор достигает этого, блокируя АТФ-связывающий карман за счёт высокой аффинности к киназному домену. Затем он связывается с активирующей петлёй и мотива DFG, останавливая переход этих участков в активное состояние. Наконец, трифторометилфенильная составляющая ингибитора стерически блокирует активирующую петлю и мотив DFG и делает невозможным их трансформацию в активную конформацию[16]. Дистальная пиридиновая группа ингибитора заякоривается в гидрофобном нуклеотид-связывающем кармане N-доли киназного домена, взаимодействуя с белковыми остатками триптофана W531 и фенилаланинов F583 и F595. Гидрофобные связи ингибитора с F583 каталитического центра фермента и F595 мотива DFG стабилизирует неактивную конформацию этих участков, снижая вероятность активации фермента. Последующие гидрофобные взаимодействия центрального фенильного кольца ингибитора с остатками K483, L514 и T529 фермента ещё более увеличивают аффинность ингибитора к киназному домену фермента. Гидрофобное взаимодействие остатка F595 с ингибитором также энергетически ещё больше снижает вероятность конформационного перехода DFG. Наконец, полярные взаимодействия ингибитора с киназным доменом далее повышают аффинность связывания ингибитора с ферментом и ещё более стабилизируют мотив DFG в его неактивном состоянии. Остатки E501 и C532 связываются водородными связями с остатком мочевины и пиридина в молекуле ингибитора, соответственно. Карбонильная группа остатка мочевины в молекуле ингибитора связывается водородной связью с азотом амида в остатке D594, что в результате полностью запирает мотив DFG[16]. Трифторометилфенильная группа цементирует термодинамическое предпочтение неактивной конформации при связывании киназного домена с ингибитором за счёт стерической блокировки гидрофобного кармана между αC- и αE-спиралей мотива DFG и активирующей петлёй, который должен бы быть задействован при переходе фермента в активную конформацию[16]. Вемурафениб PLX4032 (Вемурафениб) - ингибитор мутантной формы B-Raf V600E, одобренным FDA для лечения поздних стадий меланомы[12]. В отличие от сорафениба (BAY43-9006), который ингибирует неактивную форму киназы, вемурафениб ингибирует активную форму фермента на стадии активированного мотива DFG[17][18], прочно заякориваясь на АТФ-связывающем участке. Ингибируя только активную форму киназы, вемурафениб селективно ингибирует пролиферацию только клеток с нерегулируемой формой киназы B-Raf, которая приводит к образованию раковой опухоли. Поскольку вемурафениб отличается от своего предшественника PLX4720 только фенильным кольцом, добавленным для улучшения фармакокинетики препарата[18], механизм действия обоих веществ одинаков. PLX4720 обладает высокой аффинностью к АТФ-связывающему участку киназного домена частично за счёт заякоривающего участка молекулы ингибитора бициклического 7-аза-индола, который отличается от естественного лиганда АТФ-связывающего участка аденина только тем, что оба атома азота аденина заменены на углероды. Это обеспечивает сохранение сильных межмолекулярных взаимодействий таких как водородные связи N7 с C532 и N1 с Q530. Кроме этого, стерическое совпадение с АТФ-связывающим карманом (C532, W531, T529, L514, A481) повышает аффинность ингибитора. Водородная связь кетоновой группы и совпадение дифторфенильной группы со вторым гидрофобным карманом (A481, V482, K483, V471, I527, T529, L514 и F583) также вносит вклад в высокую аффинность связывания ингибитора с киназным доменом B-Raf. Селективность вемурафениба к активной конформации B-Raf также повышается pH-зависимым депротонированием сульфаниламидной группы, которая связывается водородной связью с NH-группой пептидной связи D594 в активном состоянии B-Raf. Дело в том, что в неактивном состоянии киназы сульфаниламидная группа вемурафениба связывается с карбонильной группой пептидной связи остатка этой аминокислоты, что приводит к отталкиванию, поэтому вемурафениб предпочтительно связывается именно с активной конформацией киназного домена B-Raf[17][18]. Клиническое значениеМутации гена BRAF способны приводить к нарушениям двумя путями. Во-первых наследственные мутации гена могут приводить к нарушениям развития. Во-вторых, ген может являться онкогеном и соматические мутации, появляющиеся на более поздних этапах, могут приводить к развитию злокачественных опухолей. Наследственные мутации BRAF приводят к кардио-фацио-кожному синдрому, заболеванию, характеризующемуся пороками сердца, умственной отсталостью и специфическим внешним видом больного[23]. Мутации этого гена обнаруживаются при многих типах злокачественных опухолей, включая такие как неходжкинские лимфомы, колоректальный рак, меланома, папиллярная карцинома щитовидной железы, немелкоклеточный рак лёгкого, лёгочная аденокарцинома, опухоль головного мозга (глиобластома, плеоморфная ксантоастроцитома), и при воспалительных заболеваниях, таких как болезнь Эрдгейма — Честера[9]. МутацииУ человека обнаружено более 30 различных мутаций гена, связанных с развитием злокачественных опухолей. Частота встречаемости мутации гена BRAF сильно различается в зависимости от типа опухоли: от более 80% при меланоме до 1-3% при лёгочной карциноме и 5% при колоректальном раке[24]. В 90% случаев, когда рак связан с мутацией BRAF, мутация вызвана заменой тимина на аденин в нуклеотиде 1799 гена. Это приводит к замене валина на глутаминовую кислоту в кодоне 600 (т.н. V600E) активирующего региона[25]. Эта мутация особенно часто наблюдается при папиллярной карциноме щитовидной железы, колоректальном раке, меланоме и немелкоклеточном раке лёгкого[26][27][28][29][30][31][32]. В 57% случаев мутация BRAF-V600E присутствует у больных гистоцитозом клеток Лангерганса[33]. Другие обнаруженные мутации: R461I, I462S, G463E, G463V, G465A, G465E, G465V, G468A, G468E, N580S, E585K, D593V, F594L, G595R, L596V, T598I, V599D, V599E, V599K, V599R, V600K, A727V и другие. Большинство этих мутаций локализованы в двух кластерах: в глицин-обогащённой P-петле N-концевой доли и в активирующем сегменте и соседних с ними регионах[16]. Эти мутации связаны с изменением активирующего сегмента из неактивного состояния в активное. Например, алифатическая цепь валина-599 взаимодействует с фенильным кольцом фенилаланина-467 в P-петле. Замена гидрофобного валина на крупные заряженные (как отрицательно-, так и положительно-заряженные) остатки при раке у человека (т.е. глутаминовая кислота, аспарагиновая кислота, лизин или аргинин) дестабилизирует взаимодействия мотива DFG в неактивной конформации, что приводит к переходу активирующего сегмента в активное состояние. В зависимости от мутации может меняться киназная активность B-Raf по отношению к различным митоген-активируемым киназом киназы (MEK). Большинство онкогенных мутаций повышают активность B-Raf. Другие вызывают рак за счёт другого механизма: хотя они могут снижать активность B-Raf, но приводят к конформационному изменению B-Raf, которая стимулирует киназу C-RAF, действующую через сигнальные пути ERK. BRAF-V600E
ВзаимодействияB-Raf взаимодействует со следующими клеточными белками: AKT1[35], C-Raf[36], HRAS[37][38] и YWHAB[39][40]. Литература
Примечания
Ссылки |