|
Фенилкетонурия
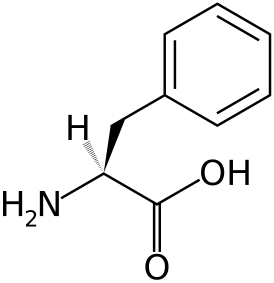
Фенилкетонури́я — наследственное заболевание группы ферментопатий, связанное с нарушением метаболизма аминокислот, главным образом фенилаланина. Несоблюдение низкобелковой диеты сопровождается накоплением фенилаланина и его токсических продуктов, что приводит к тяжёлому поражению ЦНС, проявляющемуся, в частности, в виде нарушения умственного развития (фенилпировиноградной олигофрении). Одно из немногих наследственных заболеваний, поддающихся успешному лечению. ИсторияОткрытие фенилкетонурии связывают с именем норвежского врача Ивара Асбьёрна Фёллинга, описавшего в 1934 году гиперфенилаланинемию, ассоциированную с задержкой умственного развития[2]. В Норвегии заболевание также известно под названием «болезни Фёллинга» (норв. Føllings sykdom) в честь открывателя. Успешное лечение впервые было разработано и проведено в Англии (Бирмингемский детский госпиталь) группой медицинских работников под руководством Хорста Биккеля в начале 50-х годов XX века, однако настоящий успех пришёл только после широкого применения ранней диагностики фенилкетонурии по повышенному содержанию фенилаланина в крови у новорождённых (метод Гатри, разработанный и внедренный в 1958—1961 гг). С развитием генетики и накоплением опыта в диагностике и лечении фенилкетонурии стало ясно, что за это заболевание «отвечает» единственный ген, называемый PAH[англ.][3] (12q23.2[4]; ген фенилаланингидроксилазы[5]). Выделены и описаны атипичные формы фенилкетонурии, разработаны новые методы лечения, в ближайшей перспективе — генотерапия этого тяжёлого заболевания, ставшего классическим образцом успешного оказания медицинской и организационной помощи при наследственной патологии. ЭтиологияВ большинстве случаев заболевание связано с резким снижением или полным отсутствием активности печёночного фермента фенилаланин-4-гидроксилазы, который в норме катализирует превращение фенилаланина в тирозин. До 1 % случаев фенилкетонурии представлено атипичными формами, связанными с мутациями в других генах, отвечающих за кодирование ферментов, обеспечивающих синтез кофактора фенилаланингидроксилазы — тетрагидробиоптерина (BH4). Заболевание наследуется по аутосомно-рецессивному типу. Распространённость заболевания варьирует в различных группах населения. Например, среди европеоидных жителей США встречается в среднем в 1 случае на 10 000.[6] Наиболее высокий уровень — в Турции: 1 из 2600. В Финляндии и Японии уровень фенилкетонурии крайне низок: менее 1 случая на 119 000 рождений. В исследовании 1987 года в Словакии среди отдельных цыганских популяций были обнаружены сверхвысокие уровни фенилкетонурии из-за инбридинга: 1 случай на 40 рождений.[7] Мужчины и женщины страдают в равной степени[8].
ПатогенезВследствие метаболического блока активируются побочные пути обмена фенилаланина, и в организме происходит накопление его токсичных производных — фенилпировиноградной и фенилмолочной кислот, которые в норме практически не образуются. Кроме того, образуются также почти полностью отсутствующие в норме фенилэтиламин и ортофенилацетат, избыток которых вызывает нарушение метаболизма липидов в головном мозге. Предположительно, это и ведёт к прогрессирующему снижению интеллекта у таких больных вплоть до идиотии. Окончательно механизм развития нарушений функций мозга при фенилкетонурии остаётся неясным. Среди причин также предполагается дефицит нейромедиаторов мозга, вызванный относительным снижением количества тирозина и других «больших» аминокислот, конкурирующих с фенилаланином при переносе через гемато-энцефалический барьер, и прямое токсическое действие фенилаланина. Диагностика
Производится полуколичественным тестом или количественным определением фенилаланина в крови. При нелеченных случаях возможно выявление продуктов распада фенилаланина (фенилкетонов) в моче (не ранее 10—12 дня жизни ребёнка). Также возможно определение активности фермента фенилаланингидроксилазы в биоптате печени и поиск мутаций в гене фенилаланингидроксилазы. Для диагностики 2 и 3 типа, связанных с мутацией в гене, отвечающем за синтез кофактора, необходимы дополнительные диагностические исследования. В возрасте от 2—4 месяцев у больных появляются такие симптомы, как вялость, судороги, гиперрефлексия, «мышиный» запах пота и мочи[16] или «запах волка»[17], экзема. Также среди других симптомов отмечены: мышечная гипертензия, гиперкинезы, неустойчивая походка, при несоблюдении диеты светлеют глаза, волосы, кожа (по причине недостаточного количества в организме меланина, производного тирозина); судорожные припадки[18]. Психическое состояниеПоздно выявленная, а также нелеченная или пропущенная фенилкетонурия может сопровождаться глубокой степенью умственной отсталости, обычно идиотией или имбецильностью[18], могут наблюдаться явления эхопраксии (повторение движений окружающих) и эхолалии (повторение речи)[18], также характерна вялость с редкими вспышками злобы и раздражительности[18]. Лечение и профилактикаПри своевременной диагностике патологических изменений можно полностью избежать, если с рождения и на всю жизнь ограничить поступление в организм фенилаланина с пищей. Позднее начало лечения хотя и даёт определённый эффект, но не устраняет развившихся ранее необратимых изменений тканей мозга. Некоторые из современных газированных напитков, жевательных резинок и лекарственных препаратов содержат фенилаланин в форме дипептида (аспартам), о чём производители обязаны предупреждать на этикетке. Так, например, на этикетках ряда безалкогольных напитков после указания состава и пищевой ценности 100 мл напитка приводится следующее предупреждение: «Содержит источник фенилаланина. Противопоказано применение при фенилкетонурии». При рождении ребёнка в роддомах на 3—4 сутки берут анализ крови и проводят неонатальный скрининг для обнаружения врождённых заболеваний обмена веществ. На этом этапе возможно обнаружение фенилкетонурии, и, как следствие, возможно раннее начало лечения для предотвращения необратимых последствий. В Российской Федерации детям в возрасте до 18 лет по этому заболеванию безусловно устанавливается категория «ребёнок-инвалид»[19]. Лечение проводится в виде строгой диеты от обнаружения заболевания как минимум до полового созревания, многие авторы придерживаются мнения о необходимости пожизненной диеты. Диета исключает мясные, рыбные, молочные продукты и другие продукты, содержащие животный и, частично, растительный белок. Дефицит белка восполняется аминокислотными смесями без фенилаланина. Кормление грудью детей, больных фенилкетонурией, возможно и может быть успешным при соблюдении некоторых ограничений[20][21]. Расчет диеты для больного фенилкетонурией проводит врач с учётом потребности в фенилаланине и его допустимом количестве. Допустимое количество фенилаланина для больных фенилкетонурией[22]
Некоторые (мягкие) формы заболевания поддаются лечению кофактором (тетрагидробиоптерином) поражённого фермента (фенилаланингидроксилазы). Разрабатываются новые подходы к лечению фенилкетонурии — использование заместительной терапии фенилаланинлиазой (PAL, пегвалиаза) — растительным ферментом, превращающим фенилаланин в безвредные метаболиты, и генотерапия на основе введения в организм вирусного вектора, содержащего ген фенилаланингидроксилазы. Эти методы пока не вышли из стен лабораторий. Атипичные формы в меньшей степени поддаются диетотерапии и лечатся введением препаратов тетрагидробиоптерина или его синтетических аналогов (сапроптерин).[23] См. также
Примечание
Примечания
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||