|
ТропонинТропонин — регуляторный глобулярный белок, состоящий из трех субъединиц, который участвует в процессе мышечного сокращения. Содержится в скелетных мышцах и сердечной мышце, но не содержится в гладкой мускулатуре. В ряде медицинских тестов тропонин используется как биомаркер различных сердечных заболеваний.  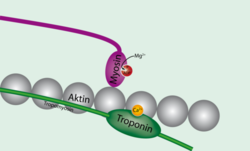 ФункцияТропонин присоединен к белку тропомиозину и расположен в желобке между актиновыми нитями в мышечном волокне. В расслабленной мышце тропомиозин блокирует место присоединения миозиновой головки к актину, предотвращая таким образом мышечное сокращение. Когда на мышечную клетку подается потенциал действия, стимулируя её сокращение, кальциевые каналы открываются в саркоплазматический ретикулум (sarcoplasmic reticulum) и выпускают ионы кальция в саркоплазму. Часть этого кальция присоединяется к тропонину, вызывая его структурное изменение, в результате которого тропомиозин сдвигается таким образом, что миозиновая головка может присоединиться к актиновой нити и вызвать мышечное сокращение. Тропонин содержится в скелетных мышцах и сердечной мышце, но некоторые элементы тропонина могут отличаться в разных типах мышечной ткани. Главное из этих отличий в том, что тропонин C в составе тропонина в скелетных мышцах имеет четыре места присоединения ионов кальция, тогда как у тропонина сердечной мышцы таких мест три. ФизиологияИ сердечная, и скелетные мышцы управляются с помощью изменения внутриклеточной концентрации кальция. Когда концентрация возрастает, мышцы сокращаются, а когда падает — расслабляются. Тропонин — комплекс белков, к которому присоединяется кальций, управляя его структурой, компонент тонких мышечных филаментов (вместе с актином и тропомиозином), располагается на тропомиозине с промежутками, длина которых равна длине тропомиозина (40 нм). Тропонин состоит из трех белков: тропонина C, тропонина I и тропонина T. Когда кальций присоединяется к определенным местам белка тропонина C, тропомиозин сдвигается с активных мест на актине, таким образом, что миозин (молекулярный мотор, образующий толстые мышечные волокна) может присоединиться к актиновому волокну и, создав силу, произвести движение. В отсутствие кальция тропомиозин служит препятствием для миозина, и мышца остается расслабленной. Также доказано in vivo и in vitro, что тропонин I подавляет ангиогенез. Отдельные элементы служат разным функциям:
В гладкой мускулатуре тропонин не содержится. Диагностическое использованиеАнализ крови на содержание тропонина может быть использован как тест на несколько различных сердечных заболеваний, включая инфаркт миокарда. История исследованияТропонин был выделен из измельченной мышечной ткани и показал активность, похожую на активность тропомиозина (Bailey, 1946, 1948; Ebashi, 1963; Ebashi, 1964). В 1965 было доказано, что это новый белок, и этот белок был назван тропонин (Ebashi и Kodama, 1965). Открытие тропонина открыло новую эру в молекулярной биологии регуляции мышечных сокращений[1]. Была показана чувствительность тропонина к ионам Ca2+ при сокращении скелетных мышц. В отсутствие ионов кальция тропонин в соединении с тропомиозином подавляет сократительное взаимодействие между актином и миозином (Ebashi, 1968). Электронно-микроскопическое исследование показало, что тропонин расположен на тонких филаментах с интервалом в 40 нм, что дало ключ к постройке стройной модели тонких волокон как упорядоченного объединения тропонина, тропомиозина и актина (Ohtsuki, 1967; Ebashi, 1969). Этими исследованиями была установлена молекулярная основа регуляции мышечного сокращениями ионами Ca2+. Примечания
Литература
Ссылки
|
Portal di Ensiklopedia Dunia