|
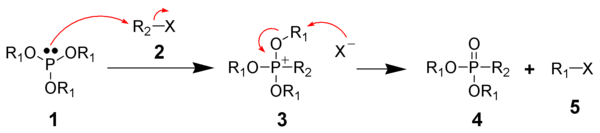
Реакция АрбузоваРеакция Арбузова (реакция Михаэлиса — Арбузова, перегруппировка Арбузова) — в классическом варианте — алкилирование триалкилфосфитов алкилгалогенидами с образованием диалкилфосфонатов: В случае, если алкильные заместители триалкилфосфита и алкилгалогенида R1 и R2 одинаковы, то говорят о перегруппировке Арбузова. Реакция открыта в 1898 году Августом Михаэлисом[1] и детально исследована Александром Арбузовым[2][3]. В настоящее время реакция Арбузова используется не только для синтеза фосфонатов из фосфитов, но и для получения фосфорильных соединений со связью C-P алкилированием или арилированием полных эфиров кислот трехвалентного фосфора: Механизм реакцииРеакция Арбузова идет через промежуточное образование фосфониевых солей с их дальнейшей перегруппировкой. На первой стадии происходит алкилирование по механизму SN2 алкилгалогенидом 2 триалкилфосфита 1 с образованием триалкоксифосфониевой соли 3. На следующей стадии происходит нуклеофильная атака галогенид-иона на электрофильный атом углерода алкоксигруппы с отщеплением алкилгалогенида 5 и образованием диалкилфосфоната 4, эта стадия получила название перегруппировки Арбузова. По аналогичному механизму протекает и алкилирование фосфинитов (A, B = R) и фосфонитов (A = R, B = OR): В реакцию Арбузова вступают и тиоаналоги эфиров кислот трехвалентного фосфора: однако в этом случае реакция осложняется конкурирующим алкилированием серы с дальнейшим отщеплением сульфида: В случае алкилирования фосфитов α-галогенальдегидами и α-галогенкетонами параллельно с реакцией Арбузова, ведущей к фосфонатам, может протекать образование винилфосфатов (реакция Перкова): Применимость и модификацииВ классическом синтезе триалкилфосфонатов из триалкилфосфитов используемый в реакции алкилгалогенид идентичен образующемуся, поэтому его берут в каталитических количествах: Триметилфосфит и другие метилфосфиты в аналогичных условиях под действием кислот Льюиса претерпевают перегруппировку Арбузова в отсутствии метилгалогенидов: В случае алкилирования другими алкилгалогенидами их берут в избыточном количестве, реакцию проводят при 100—160 °C, в случае низших алкилфосфитов (триметил-, триэтил- и т. п.) образующиеся в реакции низкокипящие галогениды отгоняют из реакционной смеси для предотвращения образования нецелевого фосфоната[4]. Использование кислот Льюиса позволяет снизить температуру реакции, так, например, в присутствии бромида цинка бензилгалогениды и их гетероциклические аналоги вступают в реакцию с триэтилфосфитом при комнатной температуре, образуя соответствующие фосфонаты с выходами 80—90 %, катализ ZnBr2 также позволяет использовать в качестве алкилирующих вместо бензилгалогенидов соответствующие бензиловые спирты с выходами фосфонатов в 75—85 %[5],[6]: Синтетическое применениеФосфонаты с подвижными атомами водорода у метиленовой группы используются как субстрат при синтезе алкенов («олефинировании карбонильной группы») по Хорнеру-Уодсворту-Эммонсу Значение реакцииПо существу, Арбузов не только нашёл важнейший путь для лабораторного и промышленного получения ФОС фосфорорганических соединений, но и разрешил серьёзную теоретическую проблему. На момент начала его исследования среди учёных не существовало единой версии о структуре фосфористой кислоты. Причём, все свои выводы о её строении они делали на основе изучения свойств её солей и органических производных. Однако ни одна из этих работ не давала чёткого ответа на поставленный вопрос. О причинах этого сам А. Е. Арбузов вспоминал впоследствии: «Не вдаваясь в подробности, могу коротко сказать, что ни один из моих предшественников по получению и изучению полных эфиров фосфористой кислоты… не сумел их приготовить. Под видом этих соединений, как я позднее выяснил, описывались смеси неопределённого состава».[7] В результате ряда неудач возник фундаментальный кризис в методологии: некоторые учёные стали даже утверждать, что теория строения органических соединений А. М. Бутлерова неприменима к органическим производным элементов с переменной валентностью ― например, к фосфору.[8] А. Е. Арбузов в серии точных лабораторных экспериментов показал, что противоречивые результаты возникали лишь по причине недостаточного знакомства со свойствами полных эфиров фосфористой кислоты, отсутствия хорошо разработанных методов их синтеза, выделения и очистки. И в первую очередь диссертанту удалось получить действительно чистые полные эфиры фосфористой кислоты.[8] Как следствие, реакция Арбузова дала точный ключ сначала к пониманию валентной структуры связей внутри формулы фосфористой кислоты, а затем и органических соединений фосфора. Тем самым подтвердила незыблемость положений теории А. М. Бутлерова. Кроме решения фундаментальной теоретической проблемы, арбузовское исследование дало ключ сначала к экспериментальному, а затем и промышленному синтезу органических производных фосфора. Эта реакция ― легла в основание всего современного производства целого класса соединений — фосфорорганических.[8] См. такжеПримечания
|