O telurito de sódio é um composto inorgânico de telúrio, sódio e oxigênio com fórmula química Na
2TeO
3
. É um sólido branco solúvel em água e um agente redutor fraco. Telurito de sódio é um intermediário na extração do elemento telúrio; é um produto obtido de lamas de ânodo e é um precursor do telúrio.
Telurito de sódio
Alerta sobre risco à saúde
|

|
|
| Outros nomes
|
Telurato (IV) de sódio
|
| Identificadores
|
| Número CAS
|
10102-20-2
|
| PubChem
|
24935
|
| Número EINECS
|
233-268-4
|
| ChemSpider
|
23309
|
| Número RTECS
|
WY2450000
|
| SMILES
|
- [Na+].[Na+].[O-][Te]([O-])=O
|
| InChI
|
1/2Na.H2O3Te/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2
|
| Propriedades
|
| Fórmula molecular
|
Na2TeO3
|
| Massa molar
|
221.57774 g/mol
|
| Aparência
|
Cristais brancos ou pó branco
|
| Densidade
|
6.245 g/cm3
|
| Ponto de fusão
|
710 °C, 983 K, 1310 °F
|
| Solubilidade em água
|
Solúvel
maior ou igual a 100 mg/mL a 68°F
|
| Estrutura
|
| Estrutura cristalina
|
Rômbica
|
| Riscos associados
|
| LD50
|
83 mg/kg (rat, oral)
|
| Página de dados suplementares
|
| Estrutura e propriedades
|
n, εr, etc.
|
| Dados termodinâmicos
|
Phase behaviour
Solid, liquid, gas
|
| Dados espectrais
|
UV, IV, RMN, EM
|
Exceto onde denotado, os dados referem-se a
materiais sob condições normais de temperatura e pressão
Referências e avisos gerais sobre esta caixa.
Alerta sobre risco à saúde.
|
Preparação
A principal fonte de telúrio é a lama anódica do refino eletrolítico do cobre, que contém vários metais preciosos, bem como vários teluretos. Essas lamas são torradas com carbonato de sódio e gás oxigênio para produzir telurito de sódio.[1]
- Ag2Te + Na2CO3 + O2 → 2Ag + Na2TeO3 + CO2 (400–500 °C)
(Esta é uma reação com telureto de prata. O telureto é oxidado para telurito e a prata(I) é reduzida para prata metálica.)
Purificação
A eletrólise de uma solução de telurito produz telúrio purificado.[1]
- Anodo: 4OH− → 2H2O + O2 + 4e−
- Catodo: TeO32− + 3H2O + 4e− → Te + 6OH−
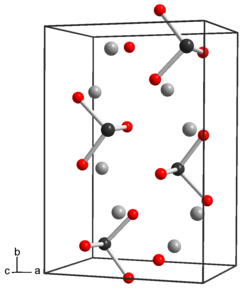
Estrutura e propriedades
O telúrio tem propriedades semelhantes ao enxofre e ao selênio. Na forma anidra Na
2TeO
3
, os átomos de telúrio são hexacoordenados, três Te-O a 1,87 Å e três a 2,9 Å , com octaedros distorcidos compartilhando bordas.[2] No pentaidrato Na
2TeO
3
•5H
2O
, há ânions telurito discretos, TeO 3 2− que são piramidais. A distância Te-O é 1,85 - 1,86 Å e o ângulo O-Te-O é próximo a 99,5°.[3] O ânion telurito é uma base fraca. O telurito de sódio seria semelhante ao selenito de sódio e ao sulfito de sódio. O telurito de sódio é um agente oxidante fraco e um agente redutor fraco.
Aplicações
Telurito de sódio melhora a resistência à corrosão de camadas de níquel eletrodepositadas. Soluções de telurito de sódio são usadas para revestimentos pretos ou azul-escuros em ferro, aço, alumínio e cobre. Em microbiologia, telurito de sódio pode ser adicionado ao meio de crescimento para isolar bactérias com uma resistência fisiológica inerente à sua toxicidade.[4]
Referências
- ↑ a b Wiberg, Egon; Holleman, Arnold Frederick (2001). Nils Wiberg, ed. Inorganic chemistry. translated by Mary Eagleson. [S.l.]: Academic Press. p. 588. ISBN 0-12-352651-5
- ↑ Masse, R.; Guitel, J.C.; Tordjman, I. (1980). «Preparation chimique et structure cristalline des tellurites de sodium et d'argent: Na2TeO3, Ag2TeO3». Materials Research Bulletin. 15 (4): 431–436. ISSN 0025-5408. doi:10.1016/0025-5408(80)90048-3
- ↑ «Etude cristallographique du tellurite de sodium à cinq molécules d'eau, Na2TeIVO3·5H2O». Acta Crystallogr. B. 35: 1337–1340. 1979. doi:10.1107/S0567740879006403
- ↑ Borsetti, Francesca; Toninello, Antonio; Zannoni, Davide (2003). "Tellurite uptake by cells of the facultative phototroph Rhodobacter capsulatus is a pH-dependent process." Federation of European Biochemical Societies. Volume 554, Issue 3, 20 November 2003, pp. 315–318. Elsevier B.V. doi:10.1016/S0014-5793(03)01180-3

