|
Oxidação de Swern
A oxidação de Swern é uma reacção química onde um álcool primário ou secundário é oxidado por um aldeído ou uma cetona na presença de cloreto de oxilo, sulfóxido dimetílico (DMSO) e uma base orgânica, como a trietilamina.[1][2][3] A reacção é conhecida pelo seu carácter suave pela sua grande tolerância a grupos funcionais.[4][5][6][7]  Os produtos da reacção são sulfito dimetílico (Me2S), monóxido de carbono (CO) e - caso a base usada seja a trietilamina - cloreto de trietilamónia (Et3NHCl). Dois dos produtos, sulfito dimetílico e monóxido de carbono, são compostos muito tóxicos e voláteis, pelo que a reacção deve ocorrer dentro de uma hotte. O sulfito dimetílico, um líquido volátil (ponto de fusão 37 °C), tem um cheiro desagradável. Um método conveniente para reduzir este odor é tratá-lo com uma solução de iões oxónio, que faz com que o sulfito se converta em sulfóxido dimetílico, que não tem cheiro. Algumas análises ao tema foram publicados.[8][9][10] MecanismoO primeiro requisito para a Oxidação de Swern é a reacção do sufóxido dimetílico (DMSO), 1a & 1b, com cloreto de oxalilo, 2. O primeiro intermédio, 3., decompõe-se facilmente libertando CO2 e CO e obtendo cloreto clorosulfodimetílico, 4. 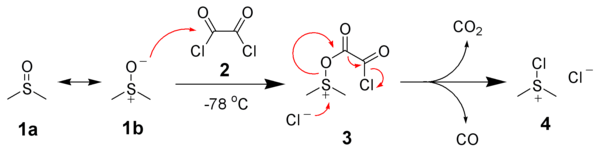 Após adição do álcool 5, o cloreto clorosulfodimetílico 4 reage com o álcool para dar o ião chave intermediário alcoxisulfureto, 6. A adição de pelo menos dois equivalentes de base - normalmente trimetilamina - vão dehidrogenar/deprotonar o ião alcoxisulfureto para fornecer o ylide sulfúrico(?) 7. Num estado de transição de anel de 5 membros, a ilida sulfúrica decompõe-se para originar sulfureto dimetílico e a cetona (ou aldeído) desejada 8.  VariaçõesQuando usando cloreto de oxilo como agente de desidrogenação, a reacção deve ser mantida abaixo dos -60 °C para evitar reacções paralelas. Com anidro trifluoroacético em vez do cloreto de oxilo, a reacção pode subir aos -30 °C sem reacções indesejadas. Em alguns casos, o uso de trimetilamina como base pode levar a uma epimerização envolvendo o recém-formado carbonilo. Usando uma base mais volumosa como, por exemplo, diisopropiletilamina (i-Pr2ENT, base de Hünig) pode-se atenuar esta reacção paralela. Referências
Ligações externasVer também |
Portal di Ensiklopedia Dunia