|
Fosfatidiletanolamina
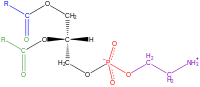
A fostatidiletanolamina é um glicofosfolipídeo, que é um derivado do composto precursor ácido fosfatídico, de acordo com o álcool polar no seu grupo-cabeça. Por exemplo, a fosfatidilcolina e fosfatidiletanolamina tem colina e etanolamina nos seus grupos-cabeça polares. Em todos esses compostos, o grupo-cabeça esta ligado ao glicerol por um fosfodiéster, no qual o grupo fosfato tem uma carga negativa em pH neutro. O álcool polar pode estar negativamente carregado (como no fosfatidillinositol 4,5 bifosfato), neutro (fosfatidilserina) ou positivamente carregado (fosfaticilcolina, fostatidiletanolamina). Essas cargas tem uma contribuição significante nas propriedades de superfície das membranas. A S-Adenosil metionina pode subsequentemente metilar a amina de fosfatidiletanolaminas para produzir fosfatidilcolinas. Pode encontrar-se principalmente na região interna (citoplasmática) da bicamada lipídica.[1] FunçõesEm célulasAs fosfatidiletanolaminas são encontradas em todas as células vivas, compondo 25% de todos os fosfolípidos. Na fisiologia humana, eles são encontrados particularmente em tecidos nervosos, como a substância branca do cérebro, nervos, tecido neural e na medula espinhal, onde compõem 45% de todos os fosfolípidos.[2] As fosfatidiletanolaminas desempenham um papel na fusão da membrana e na desmontagem do anel contrátil durante a citocinese na divisão celular.[3] Além disso, pensa-se que a fosfatidiletanolamina regula a curvatura da membrana. A fosfatidiletanolamina é um importante precursor, substrato ou doador em várias vias biológicas.[2] Como um grupo de cabeça polar, a fosfatidiletanolamina cria uma membrana lipídica mais viscosa em comparação com a fosfatidilcolina. Por exemplo, a temperatura de fusão da di-oleoil-fosfatidiletanolamina é de -16 °C enquanto a temperatura de fusão da di-oleoil-fosfatidilcolina é de -20 °C. Se os lípidos tivessem duas cadeias de palmitoil, a fosfatidiletanolamina fundiria a 63 °C, enquanto a fosfatidilcolina derreteria já a 41 °C.[4] As temperaturas de fusão inferior correspondem, em uma visão simplista, a membranas mais fluidas. Em humanosEm seres humanos, o metabolismo da fosfatidiletanolamina é considerado importante no coração, pois quando o fluxo de sangue para o coração é restrito, a distribuição assimétrica da fosfatidiletanolamina entre os folhetos da membrana é interrompida e, como resultado, a membrana é interrompida. Além disso, a fosfatidiletanolamina desempenha um papel na secreção de lipoproteínas no fígado. Isso ocorre porque as vesículas para a secreção de lipoproteínas de baixa densidade que surgem do Golgi possuem uma concentração de fosfatidiletanolamina significativamente maior quando comparada a outras vesículas contendo lipoproteínas de baixa densidade.[5] A fosfatidiletanolamina também mostrou poder propagar priões infecciosos sem a ajuda de proteínas ou ácidos nucleicos, o que é uma característica única dela[6]. É também pensado que a fosfatidiletanolamina desempenha um papel na coagulação do sangue, pois funciona com fosfatidilserina no aumento da taxa de formação de trombina promovendo a ligação ao fator V e ao fator X, duas proteínas que catalisam a formação da trombina a partir da protrombina.[7] Em bactériasOnde a fosfatidilcolina é o principal fosfolípido em animais, a fosfatidiletanolamina é a principal em bactérias. Um dos principais papéis da fosfatidiletanolamina nas membranas bacterianas é espalhar a carga negativa causada por fosfolípidos de membrana aniônica. Na bactéria Escherichia coli, a fosfatidiletanolamina desempenha um papel no apoio à permeases da lactose, ao transporte ativo de lactose na célula e também pode desempenhar um papel em outros sistemas de transporte. A fosfatidiletanolamina desempenha um papel na montagem da permease da lactose e outras proteínas de membrana. Ele atua como um "acompanhante" para ajudar as proteínas da membrana a dobrar corretamente suas estruturas terciárias para que possam funcionar corretamente. Quando a fosfatidiletanolamina não está presente, as proteínas de transporte têm estruturas terciárias incorretas e não funcionam corretamente.[8] A fosfatidiletanolamina também permite que os transportadores multidrogas bacterianos funcionem adequadamente, e permite a formação de intermediários que são necessários para que os transportadores abram e fechem corretamente.[9] EstruturaPor ser uma lecitina, (uma mistura de glicolípidios, triglicerídios e fosfolipídios), a fostatidiletanolamina consiste em uma combinação de glicerol esterificado com dois ácidos graxos e ácido fosfórico. Considerando que o grupo fosfato é combinado com colina em fosfatidilcolina, e combinado com a etanolamina em fosfatidiletanolamina. Os dois ácidos gordurosos podem ser iguais ou diferentes, e geralmente estão nas 1,2 posições (embora possam estar nas 1,3 posições). SíntesesA via de descarboxilação de fosfatidilserina e as vias de difenossulfato-etanolamina de citidina são utilizadas para sintetizar a fosfatidiletanolamina. A fosfatidilserina descarboxilase é a enzima que é usada para descarboxilação de fosfatidilserina no primeiro caminho. A via de descarboxilação de fosfatidilserina é a principal fonte de síntese para fosfatidiletanolamina nas membranas das mitocôndrias. A fosfatidiletanolamina produzida na membrana mitocondrial também é transportada por toda a célula para outras membranas para uso. Em um processo que reflete a síntese de fosfatidilcolina, a fosfatidiletanolamina também é feita através da via de difenossulfato-etanolamina citidina, utilizando-se a etanolamina como substrato. Através de várias etapas que ocorrem tanto no citosol quanto no retículo endoplasmático, o caminho de síntese produz o produto final da fosfatidiletanolamina.[10] A fosfatidiletanolamina também é encontrada abundantemente em lecitina de soja ou ovo e é produzida comercialmente usando separação cromatográfica. RegulaçãoA síntese de fosfatidiletanolamina através da via de descarboxilação de fosfatidilserina ocorre rapidamente na membrana mitocondrial interna. No entanto, a fosfatidilserina é feita no retículo endoplasmático. Por isso, ocorre o transporte de fosfatidilserina do retículo endoplasmático para a membrana mitocondrial e, em seguida, para a membrana mitocondrial interna, que limita a taxa de síntese através desta via. O mecanismo para este transporte é atualmente desconhecido, mas pode desempenhar um papel na regulação da taxa de síntese nesta via. Presença em alimentos, problemas de saúdeAs fosfatidiletanolaminas em alimentos se fragmentam para formar ‘produtos Amadori’ ligados à fosfatidiletanolamina como parte da reação de Maillard.[11] Esses produtos aceleram a peroxidação lipídica das membranas, causando estresse oxidativo para as células que entram em contato com elas.[12] O estresse oxidativo é conhecido por causar deterioração de alimentos e várias doenças. Foram encontrados níveis significativos de produtos de Amadori-fosfatidiletanolamina em uma grande variedade de alimentos, como chocolate, leite de soja, fórmula infantil e outros alimentos processados. Os níveis de produtos Amadori-fosfatidiletanolamina são maiores em alimentos com altas concentrações de lipídios e açúcares que apresentam altas temperaturas no processamento.[11] Estudos adicionais descobriram que Amadori-fosfatidiletanolamina pode desempenhar um papel na doença vascular,[13] atuam como o mecanismo pelo qual o diabetes pode aumentar a incidência de câncer [14] e também pode desempenhar um papel importante em outras doenças. A amadori-fosfatidiletanolamina tem uma maior concentração plasmática em pacientes com diabetes do que pessoas saudáveis, indicando que pode desempenhar um papel no desenvolvimento da doença ou ser um produto da doença.[15]
|
||||||||||||||||||||