|
Fenolftaleína
A fenolftaleína é um indicador de pH com a fórmula C20H14O4. Apresenta-se normalmente como um sólido em pó branco ou em solução alcoólica como um líquido incolor. É pouco solúvel em água, porém solúvel em etanol (álcool etílico). É utilizada para medir o pH (acidez ou alcalinidade) de soluções, e foi usado em "medicações" (hoje proibidas no Brasil, por exemplo), embora muito prejudicial à saúde. Usos
Utilizada frequentemente em titulações, na forma de suas soluções alcalinas, mantém-se incolor em soluções ácidas e torna-se cor-de-rosa em soluções básicas.[1] A sua cor muda a valores de pH entre pH 8,2 e pH 9,8. Se a concentração do indicador for particularmente forte, pode tomar uma cor carmim ou fúcsia. Por esta propriedade e sua destacada e intensa cor é também um componente em indicador universal, uma solução consistindo de uma mistura de indicadores de pH (normalmente fenolftaleína, vermelho de metila, azul de bromotimol e azul de timol, entre outros em variações.[2] Perícia criminal: detecção de sangue seco pelo Teste de Kastle-MeyerO Teste de Kastle-Meyer visa à identificação de sangue seco em superfícies. Procede-se com a coleta de amostra do resíduo biológico seco passando um cotonete de algodão na superfície que se deseja testar. Pingam-se algumas gotas de álcool etílico na cabeça de algodão do cotonete que entrou em contato com a superfície, seguidas de gotas de fenolftaleína e, por fim, de peróxido de hidrogênio. A fenolftaleína, como indicador de pH, possui a propriedade de apresentar coloração rosada em meio básico. Como o sangue é uma substância alcalina, se a reação apresentar imediatamente uma coloração rosada, fica comprovado que há sangue seco naquela superfície. Contudo, deve-se ter cuidado: após trinta segundos, o algodão começa lentamente a tornar-se rosado devido à própria oxidação, causada pelo peróxido de hidrogênio. A reação não é destrutiva, ou seja, preserva as moléculas de DNA do sangue para posterior análise em laboratório para fins de identificação. Entretanto, este teste tem a mesma reação com sangue de qualquer animal, consequentemente necessita-se identificar se sua origem é humana ou não. FármacoA fenolftaleína foi também utilizada como laxante que age por irritação do intestino. Era comercializada na forma de pequenas bolinhas brancas ou na forma líquida. No entanto, tem cheiro desagradável e existem medicações adequadas para a prisão de ventre, que não a fenolftaleína. No Brasil, o uso da fenolftaleína como laxante foi proibido pela ANVISA por suspeita de ser cancerígeno.[3][4] Os medicamentos que a continham como laxante eram o Lacto-Purga e o Almeida Prado nº 46 (este último, a despeito de fazer parte de uma linha de "medicamentos" homeopáticos) que, agora, não mais a contêm. Produtos com alteração de corFenolftaleína é usada em alguns brinquedos, para desenvolver o cabelo e padrões gráficos "mágicos", a tinta é espargida com uma solução de hidróxido, a qual conduz a aparição de caracteres destacados pelo mesmo mecanismo descrito acima para a mudança de cor em solução alcalina. O padrão irá eventualmente desaparecer pelo mesmo mecanismo de reação com dióxido de carbono detalhado anteriormente. Timolftaleína é usado para o mesmo propósito, quando cor azul é desejada.[1] Comportamento químico em função do pHA fenolftaleína é frequentemente utilizada em titulações ácido-base, sendo que sua coloração muda de incolor em meio ácido para rosa em soluções básicas. Se a concentração do indicator é particularmente forte, ela poderá apresentar-se como púrpura. Em soluções fortemente básicas (pH maior que 12), a coloração rosa da fenolftaleína submete-se lentamente a uma reação de descoloração e torna-se incolor novamente. Essa reação mais lenta, que produz o íon InOH3−, é algumas vezes utilizada em aulas de química para o estudo da cinética química. A molécula tem quatro formas:
ObtençãoFenolftaleína é sintetizada pela condensação de anidrido ftálico com dois equivalentes de fenol sob condições ácidas (daí seu nome). Foi descoberta em 1871 por Adolf von Baeyer.[5][6][7] 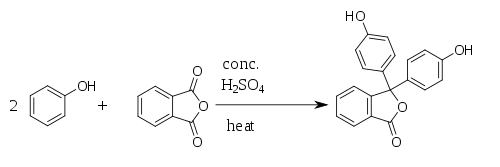 Ver tambémReferências
Ligações externas
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia











