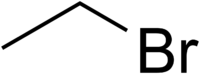
Bromoetano
Alerta sobre risco à saúde
|
|

|
| Nome IUPAC
|
Bromoetano
|
| Outros nomes
|
Brometo de etila
|
| Identificadores
|
| Número CAS
|
74-96-4
|
| Número RTECS
|
KH6475000
|
| SMILES
|
|
| Propriedades
|
| Fórmula molecular
|
C2H5Br
|
| Massa molar
|
108.97 g/mol
|
| Aparência
|
Líquido incolor
|
| Densidade
|
1.47 g/cm3, líquido
|
| Ponto de fusão
|
−119 °C (154 K)
|
| Ponto de ebulição
|
38.4 °C
|
| Solubilidade em água
|
0.91 g/100 ml (20 °C)
|
| Viscosidade
|
0.402 cP at 20 °C
|
| Riscos associados
|
| Classificação UE
|
Inflamável (F)
Carc. Cat. 3
Nocivo (Xn)
|
| NFPA 704
|
|
| Frases R
|
R11, R20/22, R40
|
| Frases S
|
S2, S36/37
|
| Ponto de fulgor
|
−20 °C
|
Temperatura
de auto-ignição
|
511 °C
|
| Limites de explosividade
|
6.8–11%
|
| Compostos relacionados
|
| haloalcanos relacionados
|
bromometano
Cloroetano
Iodoetano
Brometo de n-propila
|
| Página de dados suplementares
|
| Estrutura e propriedades
|
n, εr, etc.
|
| Dados termodinâmicos
|
Phase behaviour
Solid, liquid, gas
|
| Dados espectrais
|
UV, IV, RMN, EM
|
Exceto onde denotado, os dados referem-se a
materiais sob condições normais de temperatura e pressão
Referências e avisos gerais sobre esta caixa.
Alerta sobre risco à saúde.
|
Bromoetano, também conhecido como brometo de etila é um composto químico do grupo dos haloalcanos. É abreviado pelos químicos como EtBr. Este composto volátil tem odor similar aos éteres.
Síntese
A preparação de EtBr estabelece-se como um modelo para a síntese de brometos de alquila em geral. É usualmente preparado pela adição de HBr a etileno:
- H2C=CH2 + HBr → H3C-CH2Br
Brometo de etila é barato e raramente é preparado em laboratório. Sínteses laboratoriais convenientes incluem a ação de tribrometo de fósforo ou brometo de tionila sobre etanol. EtBr forma-se quando etanol é tratado com HBr (gás) ou ácido bromídrico (sua solução aquosa), embora esta reação também forme éter dietílico.
Usos
Em síntese orgânica, EtBr é o equivalente sintético do carbocátion etil (Et+) "synthon". Na realidade, tal cátion não é realmente formado. Por exemplo, sais carboxilatos são convertidos a ésteres de etila,[1] carbânions a derivados etilados, tiouréia em sais de etilisotiourônio,[2] a aminas em etilaminas.[3]
Sendo um líquido a temperatura ambiente mas também muito volátil, EtBr é um reagente barto para a preparação de reagentes de Grignard, os quais tradicionalmente são usados como bases fortes. Visto que EtMgBr deprotona alcinos:[4][5][6]
- EtBr + Mg → EtMgBr
- RC≡CH + EtMgBr → RC≡CMgBr + EtH
Esta aplicação tem sido suplantada pela grande disponibilidade de reagentes organolítios.
Segurança
Halocarbonetos em geral são agentes alquilantes potencialmente perigosos. Brometos são agentes alquilantes superiores aos cloretos, assim exposição a EtBr deve ser minimizada. EtBr é classificado pelo estado da Califórnia como carcinogênico e uma toxina reprodutiva.
Referências
- ↑ Petit, Y.; Larchevêque, M.. "Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate". Org. Synth. 75: 37; Coll. Vol. 10: 401.
- ↑ E. Brand, E.; Brand, F. C.. "Guanidodacetic Acid". Org. Synth. 22: 440; Coll. Vol. 3.
- ↑ {Brasen, W. R; Hauser, C. R.. "o-Methylethylbenzyl Alcohol". Org. Synth. 34: 58; Coll. Vol. 4: 582.
- ↑ Taniguchi, H.; Mathai, I. M.; Miller, S. I.. "1-Phenyl-1,4-Pentadiyne and 1-Phenyl-1,3-Pentadiyne". Org. Synth. 50: 97; Coll. Vol. 6: 925.
- ↑ A. J. Quillinan, A. J.; Scheinmann, F.. "3-Alkyl-1-alkynes Synthesis: 3-Ethyle-1-hexyne". Org. Synth. 58: 1; Coll. Vol. 6: 595.
- ↑ Newman, M. S.; Stalick, W. M.. "1-Ethoxy-1-butyne". Org. Synth. 57: 65; Coll. Vol. 6: 564.
- Makosza, M.; Jonczyk, A.. "Phase-Transfer Alkylation of Nitriles: 2-Phenylbutyronitrile". Org. Synth. 55: 91; Coll. Vol. 6: 897.
Ligações externas


