|
Anemia falciforme
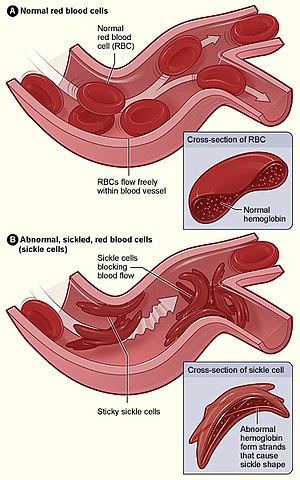
Anemia drepanocítica, drepanocitose ou anemia falciforme (do latim falci-, foice e -forme, formato de) é uma doença hematológica hereditária monogénica,[2] caracterizada pela produção anormal de hemoglobinas, entre as quais a mais comum é a forma HbS (de Sickle, foice), que sob determinadas condições de desoxigenação, polimeriza, deformando as hemácias, que assumem uma forma semelhante a foices, causando deficiência no transporte de oxigénio e gás carbónico e outras complicações, nos indivíduos acometidos pela doença.[9][10] Por esse motivo, a anemia drepanocítica é também conhecida por anemia falciforme. Do ponto de vista patogenético, está classificada entre as anemias por "defeito da síntese de hemoglobina", a proteína que transporta oxigénio presente nos glóbulos vermelhos, embora a anemia seja em parte determinada pela hemólise esplénica. Os sintomas geralmente começam a aparecer entre os 5 e 6 meses de idade. Podem desenvolver-se vários problemas de saúde, tais como crises de dor, anemia, infecções bacterianas e acidentes vasculares cerebrais.[1] Podem desenvolver-se dores crónicas à medida que a pessoa envelhece. A esperança média de vida nos países desenvolvidos varia entre os 40 e 60 anos.[2] A anemia falciforme ocorre quando a pessoa herda duas cópias anormais do gene de hemoglobina, um de cada progenitor.[3] Existem vários subtipos, dependendo da mutação exacta em cada gene de hemoglobina.[2] Um ataque pode configurar-se por mudanças de temperaturas, stress ou desidratação em sítios de elevada altitude.[1] Uma pessoa com uma só cópia anómala normalmente não apresenta sintomas e diz-se que possui um traço drepanocítico ou falcémico.[3] Estas pessoas são também referidas como portadoras da doença.[5] O diagnóstico é feito por um exame de sangue e alguns países examinam todos os bebés quando nascem.[4] O diagnóstico pode também ser feito durante a gravidez.[4] O tratamento da pessoa com anemia falciforme pode incluir a prevenção a infecções através da vacinação e uso de antibióticos, uma elevada ingestão de líquidos, a suplementação de ácido fólico e fármacos analgésicos.[5][6] Outras medidas podem incluir a transfusão de sangue e a prescrição de hidroxicarbamida (hidroxiureia).[6] Um reduzido percentual de pessoas pode ser curado mediante um transplante de células da medula óssea.[2] Em 2013, cerca de 3,2 milhões de pessoas sofriam de anemia drepanocítica, enquanto mais de 43 milhões apresentavam traço falciforme.[11] Considera-se que cerca de 80% dos casos de anemia falciforme ocorram na África subsariana.[12] É relativamente comum em algumas partes da Índia, da península arábica e entre pessoas de origem africana que vivem noutras parte do mundo.[13] No mesmo ano, a anemia falciforme provocou 176.000 mortes, acima das 113.000 mortes registadas em 1990.[14] A primeira descrição médica da doença foi realizada pelo médico norte-americano James B. Herrick, em 1910.[15][16] Em 1949, E. A. Beet e J. V. Neel determinaram a origem genética. Em 1954 foi descrito o efeito protector contra a malária do traço falciforme.[16] CausasA presença da anemia falciforme, é determinada por uma quantidade elevada de hemácias deformadas. Em indivíduos normais, as células de transporte de gases, hemácias (também conhecidas como eritrócitos ou glóbulos vermelhos), têm forma arredondada côncava e flexível, e possuem em si moléculas de hemoglobina,que são responsáveis por fazer as ligações gasosas. Essa constituição permite que essas células consigam executar sua função mesmo através dos mais finos capilares. A formação dessa hemoglobina, determinada por um par genético no cromossomo 11, muda nos indivíduos falciformes. Neles, há a presença de ao menos um gene mutante, que leva o organismo a produzir a hemoglobina S (HbS). A descoberta dos polimorfismos da mutação (GAT→GTG) no gene que codifica a cadeia β da hemoglobina, originando diferentes haplótipos da doença, permitiu um melhor e mais amplo conhecimento em torno da heterogeneidade clínica nos pacientes falcêmicos. Analisando a hemoglobina na sua estrutura normal e mutante, sua produção e evolução, pode-se ter um entendimento mais completo da fisiopatologia desta doença e da sua complexidade clínica. A substituição da base nitrogenada timina (T) por adenina (A), ocasionando a substituição do aminoácido ácido glutâmico por valina, na posição seis da cadeia β, é a mesma para todo paciente. A polimerização da hemoglobina S (HbS) e a falcização das hemácias são extremamente bem conhecidas. As variações das condições climáticas, sociais, econômicas e de cuidados médicos contribuem para esta diversidade, mas não explicam todo o seu contexto ( Nagel, R.L. et al. Hematologically and genetically distinct forms of sickle cell anemia in Africa. N. Engl. J. Med., 312: 880-4, 1985, Aspectos moleculares da anemia falciforme Galiza Neto & Pitombeira.) A homozigosidade para esta mutação é a causa dessa anemia falciforme. Um heterozigoto tem uma mistura dos dois tipos de hemoglobinas, A (HbA) e S (HbS), além de um tetrâmero híbrido de Hemoglobina. Ela consegue transportar o oxigênio mas, quando o mesmo passa para os tecidos, as moléculas da sua hemoglobina se aglutinam em formas gelatinosas de polímeros, também chamadas tactóides, que acabam por distorcer as hemácias, que se tornam duras e quebradiças devido às mudanças na sua membrana. Quando recebem novamente o oxigênio, podem ou não reganhar seu formato: após algum tempo, por não suportar bem modificações físicas, a hemoglobina pode manter a forma gelatinosa permanentemente e, consequentemente, a deformação que ela gera. Nessa forma, sua vida útil se extingue mais rapidamente, o que pode vir a causar anemia hemolítica (ou comum). Contudo, ao contrário da anemia comum, não há tratamento definitivo para a forma falciforme. O gene causador desse último problema tem uma relação de co-dominância com o gene normal. Assim, há indivíduos portadores de uma forma branda e de uma forma severa da mesma doença. Doença falciformeA anemia falciforme obedece a um modelo de herança tipo autossômica recessiva[17] É chamado portador de anemia falciforme o paciente que apresenta o gene da hemoglobina S (HbS) em homozigose e portador do traço falcêmico o indivíduo que apresenta o gene da HbS em heterozigose (HbS - HbA). Observe-se porém que existe expressão clínica patológica caso o gene HbS se apresente em qualquer heterozigota mista, que não a combinação com a hemoglobina mais frequente (HbA) caracterizando o portador normal traço falcêmico. Na combinação do gene HBS com genes determinantes de variantes da hemoglobina (HbC; HbD) ou de hemoglobinas anômalas causadoras de outras formas de anemia hereditária tipo a talassemia Caso o gene HBS temos o que se denomina Doença Falciforme (SC; SD; S-talassemia, etc.) com sintomatologia semelhante, ou mais grave a da anemia falciforme.[18] Sinais e sintomasHá a presença de alguns dos sintomas clássicos da anemia, causados pela falta e ineficiência de hemácias como:
Há, contudo, a presença de uma gama de sintomas característicos da anemia falciforme aguda, que são causados pelo aumento da viscosidade sanguínea, que é a aglomeração de hemácias comprometidas. Por causa disso, pode haver formação de trombos (coágulos) nas mais diversas áreas do organismo, com défice do transporte sanguíneo para a área. Em regiões musculares ou conjuntivas, isso pode causar crises de dor intensa. Concomitantemente a isso, há um aumento do número de hemácias comprometidas, uma vez que a acidose e a deficiência de oxigênio facilita a deformação permanente. Pode causar também hemorragia, descolamento retiniano, priapismo, acidente vascular cerebral, enfarte, calcificações em ossos com dores agudas, insuficiência renal e pulmonar, dependendo da fase de vida. Nas mãos e nos pés principalmente das crianças, pode haver tumefacção causado pela obstrução de vasos naquelas áreas, também acompanhado de dor. Pode ainda ocasionar uma maior suscetibilidade à infecções. Epidemiologia  No ocidente, a prevalência é de cerca de 1 em cada 5000, mas em áreas endêmicas da Índia, Arabia Saudita e Nigéria a prevalência varia entre 2 e 22,2%. Nessas regiões é comum encontrar pessoas resistentes a doença, produzindo maior quantidade de hemácias saudáveis.[20] Em 2001, 90% sobreviviam até os 20 anos e 50% até os 50 anos, sendo muitas das mortes causadas por outras doenças endêmicas da região, como malária e AIDS.[21] Relação com a maláriaOs portadores da anemia falciforme são geralmente mais resistentes à malária do que as pessoas que não têm essa deficiência. Isso ocorre pois os protozoários Plasmodium necessariamente se reproduzem no interior das hemácias humanas e as hemácias danificadas do indivíduo falciforme não são adequadas a esse tipo de função, mesmo quando exposto ao vetor da doença, o mosquito Anopheles contaminado. TratamentoA única cura para a anemia falciforme é o transplante de medula óssea. Este tratamento, no entanto, foi realizado em um número relativamente grande de pacientes ao redor do mundo, com maior taxa de sucesso entre crianças. Ainda é necessário um número maior de estudos e a determinação de características clínicas que permitam indicar o transplante com maior segurança. Alguns trabalhos experimentais tem sido feitos com terapia gênica. Do ponto de vista clínico, o uso de hidroxiuréia, um quimioterápico inibidor da ribonucleotidase vem se revelando útil, por diminuir o número de episódios dolorosos e síndrome torácica aguda. Esta medicação atua por diversos meios, aumentando hemoglobina fetal, diminuindo leucócitos e reticulócitos aderentes ao endotélio e elevando os níveis de óxido nítrico. O uso de hidroxiuréia deve ser feito com supervisão médica, pelo risco de depressão da função da medula óssea e infecções. Além disso os usuários não podem engravidar durante seu uso pelo risco de teratogenicidade para o feto. A experiência clínica de 25 anos com esta medicação não revelou aumento da chance de câncer em seus usuário e trabalhos recentes sugerem aumento da sobrevida dos pacientes. São realizadas transfusões durante exacerbações da anemia. Pacientes com complicações graves, como acidente vascular cerebral, são submetidos a regimes regulares de transfusão sanguínea ou exsanguineo-transfusão, em geral a cada 28 dias. Pacientes neste regime tendem a acumular ferro no organismo (hemossiderose), o que pode ser controlado com o uso de substâncias quelantes. Se o ferro não for adequadamente quelado pode se depositar em órgãos como fígado e coração trazendo outras complicações. Durante crises, deve ser administrada hidratação intravenosa e analgesia preferencialmente com opioides. É sugerido que o uso de dolantina, um dos opioides endovenosos, seja evitado, pelo risco maior de dependência.Toda crise dolorosa tem de ser avaliada como prenúncio de complicações graves, como a síndrome torácica aguda. O tratamento deve evitar hiper-hidratação e hiper-sedação e privilegiar a fisioterapia respiratória. CuraAnunciado em 12 de junho de 2020, resultado de um estudo preliminar, mostra que o CRISPR fornece 'cura funcional' para pacientes com talassemia beta e doença falciforme.[22] Embora os três pacientes tenham experimentado alguns efeitos adversos devido à quimioterapia, a edição do gene CRISPR parece segura.[23] Referências
Ligações externas |
||||||||||||||||||||||||||||||||||||||||||||||