|
Amida Amidas é uma função orgânica em que um átomo de nitrogênio liga-se diretamente a um grupo acila (R-C=O)[1]. Quando o oxigênio na fórmula do oxiácido é substituído por enxofre, a função é tioamida[2]. O termo também é aplicado para derivados metálicos de amônia e de aminas, quando o hidrogênio é substituído por um catião metálico[2]. Estes compostos também são chamados de azanidas. Exemplo: amida de sódio (NaNH2) e di-isopropilamida de lítio (LDA)[2]. As proteínas são polímeros, formadas pela condensação de aminoácidos através de ligações amida, que também recebe o nome de ligações peptídicas.[3][4][5][6] Este artigo se refere às amidas derivadas de ácidos carboxílicos, também chamadas de grupo amida ou, especificamente, grupo carboxamida (-CONH2).[2] Nomenclatura, classificação e exemplosConforme o nitrogênio estabeleça ou não outras ligações com carbono, as amidas podem ser divididas em 3 grupos:  Amida não-substituída: apresenta 2 hidrogênios ligados ao nitrogênio. Nomenclatura: Prefixo + Infixo + Amida Amida monossubstituída: apresenta 1 hidrogênio substituído por 1 radical (cadeia carbônica). Nomenclatura: N + nome do radical ou N,N + nome dos radicais + prefixo + infixo + amida Amida dissubstituída: apresenta 2 hidrogênios substituídos por 2 radicais iguais ou diferentes. Nomenclatura: N + nome do radical ou N,N + nome dos radicais + prefixo + infixo + amida Nomenclatura oficial IUPAC: prefixo + infixo + amida Os nomes usuais seguem os nomes usuais dos ácidos carboxílicos. As amidas secundárias também são conhecidas por imidas e as amidas cíclicas por lactamas. Estrutura A planaridade da ligação C=O se estende aos grupos ligados ao nitrogênio, conforme a figura ao lado. Esta propriedade é atribuída à deslocalização do par de elétrons do átomo de nitrogênio até grupo carbonil, formando assim uma dupla ligação parcial entre nitrogênio e carbono. De fato, os átomos de O, C e N têm orbitais moleculares ocupados por elétrons deslocalizados, formando um sistema conjugado. Consequentemente, as três ligações do nitrogênio nas amidas não são piramidais (como nas aminas), mas planas.   Propriedades físicas da amidaAs amidas apresentam pontos de ebulição e fusão maiores do que os hidrocarbonetos de massa molecular semelhante e esta propriedade é atribuída às interações intermoleculares. Amidas com ligações N-H (primárias e secundárias) interagem por ligações de hidrogênio diméricas, enquanto amidas terciárias interagem por dipolo-dipolo. Veja na tabela que o ponto de ebulição diminui consideravelmente quando as moléculas não têm a ligação N-H disponível para interação por ligações de hidrogênio:
Métodos de obtençãoA função amida é muito comum nas proteínas, unindo os aminoácidos e recebe o nome específico de ligação peptídica.
Propriedades químicasComparadas às aminas, as amidas são bases muito fracas. Enquanto o ácido conjugado de uma amina tem um pKa de cerca de 9,5, o ácido conjugado de uma amida tem um pKa em torno de -0,5. Portanto, as amidas não têm propriedades ácido-base claramente perceptíveis na água. Essa relativa falta de basicidade é explicada pela deslocalização do par de elétrons do nitrogênio. As amidas primárias e secundárias são ácidos muito fracos, com pKa próximo a 15.  A função amida é a menos reativa dentre os derivados de ácido, como ésteres, anidridos de ácido carboxílico e cloretos de ácido. Dentre estas funções orgânicas, é a mais resistente à hidrólise, o que torna ela a melhor para a constituição das proteínas. A hidrólise de amidas requer condições drásticas, como aquecimento em NaOH 4 mol/L ou HCl 6 mol/L. As condições ácidas produzem o ácido carboxílico e o íon amônio, enquanto a hidrólise básica produz o íon carboxilato e a amônia. A protonação da amina gerada inicialmente sob condições ácidas e a desprotonação do ácido carboxílico gerado inicialmente sob condições básicas tornam esses processos não catalíticos e irreversíveis. Enzimas peptidases e catalisadores artificiais aceleram as reações de hidrólise. Outras reações:
EspectroscopiaA presença do grupo amida - C (= O) N - geralmente é facilmente estabelecida, pelo menos em pequenas moléculas. No espectro de infravermelho, as amidas exibem uma banda νCO moderadamente intensa perto de 1650 cm -1. Dentre os derivados de ácido carboxílico, este é o menor valor para a frequência de estiramento da ligação carbonila, o que é atribuído ao caráter intermediário entre ligação simples e dupla desta ligação, conforme as estruturas de ressonância. No espectro de 1H RMN, os sinais CONHR ocorrem em campos baixos. Na cristalografia de raios X, o centro C (= O) N, juntamente com os três átomos imediatamente adjacentes, caracteristicamente define um plano.
Aplicações das amidas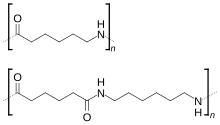 As amidas são utilizadas em muitas sínteses em laboratório e como intermediários industriais na preparação de medicamentos e outros derivados. O nylon é uma poliamida muito importante dentre os polímeros. A ureia, de fórmula CO(NH2)2, é uma diamida do ácido carbônico, encontrada como produto final do metabolismo dos animais superiores, e eliminada pela urina. A amida do ácido sulfanílico (sulfanilamida) e outras amidas substituídas relacionadas com ela, têm considerável importância terapêutica e conhecem-se por sulfamida. Ver também
Referências
|