|
Ácido fluorantimônico
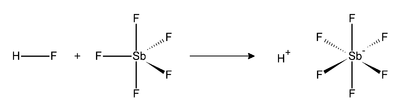
Ácido fluorantimônico, de fórmula molecular HSbF6, é o mais forte superácido conhecido. É obtido pela reação de pentafluoreto de antimônio (fórmula molecular: SbF5) e fluoreto de hidrogênio (fórmula molecular: HF) em proporções diversas; com uma proporção molar de 1 para 1, tem-se máxima acidez, podendo formar soluções de pH inferior a -24,[1] sendo 2×1019 vezes mais ácido que o ácido sulfúrico.[2] Devido à seu elevado potencial corrosivo, este ácido dissolve vidros plásticos e a maior parte dos materiais existentes. Deste modo ele somente pode ser armazenado em recipientes especiais feitos com politetrafluoretileno.[3] O nível de acidez apresentado por esta substância é tão elevado que caso respingue nas mãos de quem o manipula, é capaz de corroê-la totalmente, incluindo os ossos.[4] É uma combinação de fluoreto de hidrogênio e SbF5. Neste sistema, o HF, anidro, se ioniza, unindo-se o fluoreto ao SbF5, formando-se SbF6-, o qual é simultaneamente um nucleófilo muito débil e uma base muito débil. O próton fica literalmente "nu", o que dá ao sistema uma acidez extrema. A reação entre o fluoreto de hidrogênio e o pentafluoreto de antimônio é exotérmica. O HF libera seu cátion (H+), e seu ânion (F-) que é sequestrado por uma ou mais moléculas de SbF5, formando um SbF6- octaédrico. A reação é a seguinte: Referências
|
||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia