|
18-elektronenregelDe 18-elektronenregel[1][2][3] is een regel in de scheikunde die vooral zijn waarde bewijst bij het voorspellen van de formules van stabiele metaalcomplexen. De theoretische achtergrond van de regel is gebaseerd op het feit dat de valentieschil van overgangsmetalen bestaat uit negen valentieorbitalen die met elkaar ruimte bieden aan 18 elektronen. De elektronen kunnen als bindend elektronenpaar optreden tussen het metaal en een ligand, maar ook als vrij elektronenpaar aanwezig zijn. Een andere manier om hetzelfde te zeggen is dat de negen atoomorbitalen samen met de aanwezige ligandorbitalen leiden tot negen moleculaire orbitalen die zowel bindend als niet-bindend karakter kunnen bezitten. Als er 18 valentie-elektronen in een complex aanwezig zijn, dan heeft het complex dezelfde elektronenconfiguratie als het edelgas aan het einde van de periode uit het periodiek systeem waar het metaal in staat. De regel, en de uitzonderingen erop, zijn vergelijkbaar met de octetregel voor de elementen van de hoofdgroepen van het periodiek systeem. Deze regel kan niet toegepast worden op de (aard)-alkalimetalen, de lanthaniden en de actiniden. De 18-elektronenregel werd in 1927 voor het eerst geformuleerd door de Britse scheikundige Nevil Sidgwick. Toepassingen van de 18-elektronenregelHoewel veel complexen niet volgens deze regel zijn opgebouwd geldt hij wel voor de low-spin-complexen van chroom, mangaan, ijzer en kobalt. Bekende voorbeelden van deze groep verbindingen zijn ferroceen, ijzerpentacarbonyl, chroomhexacarbonyl en nikkeltetracarbonyl. Of complexen beschreven kunnen worden met deze regel is voor een deel afhankelijk van de optredende liganden. Vaak geldt dat een deel van de liganden vanuit een π-systeem aan het metaal binden. Dit soort liganden heeft een sterk kristalveld-effect, waardoor de resulterende moleculaire orbitalen sterk gestabiliseerd zijn. Typische voorbeelden van dit soort liganden zijn alkenen, fosfanen en koolstofmonoxide (of carbonylverbindingen). Complexen met π-liganden treden vooral op bij de lagere oxidatietoestanden van het metaal. De verklaring hiervoor wordt gevonden in het verschijnsel van π-backbonding, dat bij lagere oxidatietoestanden makkelijker optreedt. Implicaties voor de reactiviteitVerbindingen die voldoen aan de 18-elektronenregel zijn over het algemeen vrij inert tegenover liganduitwisseling. Duidelijke voorbeelden hierin zijn hexaminekobalt(III)chloride, molybdeenhexacarbonyl en hexacyanoferraat(II). Bij dergelijke complexen verloopt de liganduitwisseling via dissociatieve substitutie (een aan de in de organische chemie bekende SN1-reactie), waarbij de reactiesnelheid bepaald wordt door de dissociatiesnelheid van het complex. Anderzijds kunnen 18-elektronenverbindingen zeer reactief zijn ten opzichte van elektrofielen zoals het waterstofion (H+). De reacties kunnen dan meer beschreven worden als zuur-basereacties. Complexen met minder dan 18 elektronen vertonen meestal een verhoogde reactiviteit. De 18-elektronenregel kan zo ook vaak gebruikt worden als een aanwijzing voor de afwezigheid van reactiviteit. Uitzonderingen op de 18-elektronenregelComplexen met 16 elektronenEen grote groep complexen voldoet niet aan de 18-elektronenregel, omdat ze over slechts 16 elektronen beschikken. Voorbeelden van dit soort complexen treden vooral op bij een d8-configuratie van het complex, waarbij dan een vierkant-planaire geometrie behoort. Dit komt veel voor bij metalen van de kobalt- en nikkel-groep. De bekendste vertegenwoordigers van deze groep verbindingen zijn Vaska's complex, [PtCl4]2− en Zeise's zout. In deze complexen is het dz2-orbitaal door twee elektronen bezet en niet-bindend. 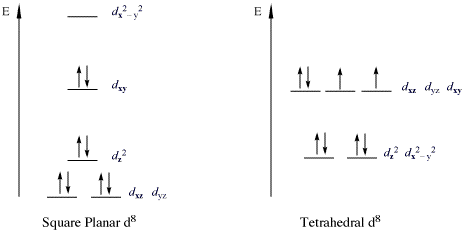 Veel katalytische cycli werken via de wisseling tussen het niet-vlakke 18-elektroncomplex en het vierkant planaire 16-elektron-complex. Voorbeelden van dergelijke reacties zijn het Monsanto-proces voor de productie van azijnzuur, de hydrogenerings-, de hydroformylerings-, alkeenisomerisatie- en sommige polymerisatiereacties. Een aantal uitzonderingen op de 18-elektronenregel kunnen op basis van de in het complex voorkomende liganden gekarakteriseerd worden. Grote ligandenLiganden die veel ruimte innemen kunnen voorkomen dat een metaal zijn volledig aantal van 18 elektronen in zijn valentieschil kan opbouwen. Voorbeelden van dergelijke liganden (en complexen) zijn:
High spin-complexenComplexen met een zogenaamde high spin beschikken over orbitalen waar slechts één elektron in geplaatst is. Dit kan tot gevolg hebben dat er geen vrije orbitalen zijn waaraan liganden elektronen kunnen doneren. In het algemeen hebben deze complexen geen of weinig liganden die als π-donor kunnen optreden. Deze enkel-bezette orbitalen kunnen wel combineren met enkel-bezette orbitalen in liganden zoals in dizuurstof), of additie van een sterke veldligand kan aanleiding zijn tot het plaatsen van twee elektronen in één orbitaal (de spin wordt lager), maar er ontstaat ook een vrije orbitaal die gebruikt kan worden om elektronen aan te doneren. Voorbeelden:
Complexen waarin sterke π-donerende liganden optreden volgen ook vaak de 18-elektronenregel niet. Deze liganden omvatten onder andere fluoride (F−), oxide (O2−), nitride (N3−), alkoxide (RO−) en imide (RN2−). Voorbeelden:
In het laatste geval is er sprake van een aanzienlijke bijdrage vanuit het vrije elektronenpaar op stikstof naar molybdeen toe, waarmee de verbinding ook als een 16-valentie-elektronencomplex beschreven kan worden. Dit wordt nog versterkt door de korte bindingsafstand tussen molybdeen en stikstof en de grootte van de bindingshoek Mo-N-C(R), die bijna 180° bedraagt. Voorbeelden van juist het tegenovergestelde effect zijn:
In deze gevallen is de M=O-binding een echte dubbele binding, dat wil zeggen dat er geen bijdrage is vanuit de vrije elektronenparen van zuurstof in de richting van het metaal. In de relatief grote bindingslengte wordt dit laatste nog eens onderstreept. Pi-donerende ligandenLiganden waarbij het coördinerende atoom niet-bindende vrije elektronenparen hebben, zijn vaak goede stabilisatoren voor onverzadigde complexen. Metaalamiden en -alkoxiden gedragen zich vaak in strijd met de 18-elektronenregel. Verschillende effecten tegelijkertijdDe bovengenoemde factoren komen soms in één complex samen. Voorbeelden hiervan zijn:
Meer dan 18 elektronenSommige complexen hebben meer dan 18 valentie-elektronen. Voorbeelden hiervan zijn:
In gevallen waarbij complexen over meer dan 18 valentie-elektronen beschikken zijn vaak elektrostatische krachten de achterliggende oorzaak. Door de positieve lading van het metaal worden liganden aangetrokken, het aantal elektronen dat daarmee gemoeid is maakt geen verschil uit. In het geval van de metallocenen moet de oorzaak gezocht worden in de eigenschappen van de cyclopentadienylring als ligand. Dat het hier om speciale gevallen gaat blijkt uit de constatering dat enerzijds kobaltoceen een sterke elektrondonor (reductor) is, waarbij het 18-elektron kobaltoceniumkation ontstaat en anderzijds nikkeloceen makkelijk reageert met allerlei liganden waarbij de 18-elektronverbinding gevormd wordt, samen met vrij cyclopentadieen. Zie ook |