|
TLR4 TLR4(Toll様受容体4、英:Toll-like receptor 4)は病原体に特徴的な分子を認識するToll様受容体の1つで、グラム陰性菌の外膜の成分であるリポ多糖(LPS)やグラム陽性菌のペプチドグリカン層にあるリポテイコ酸をリガンドとして認識する受容体である。通常の免疫反応に関わる一方で、リガンドが多すぎる場合には細菌性ショック(敗血症)を起こしうる。 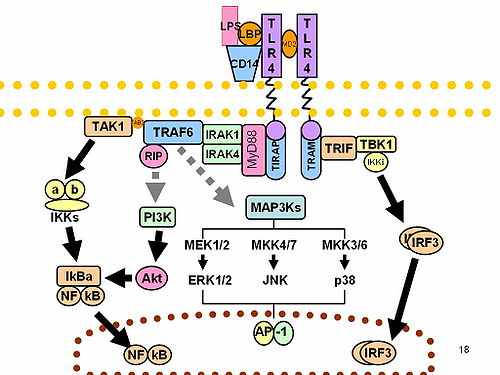 リガンドの認識機構TLR4はもともとリポ多糖(LPS)を認識する受容体としてその機能が同定されたものである。血中のリポ多糖はまず、肝臓で作られるリポ多糖結合タンパク質(LPS binding protein: LBP)と結合した後、細胞膜上のCD14に運ばれる。そしてCD14からTLR4とMD2の複合体に受け渡される時にTLR4が二量体となり細胞内にシグナルが伝わる。このシグナル経路ではまず、TLR4の細胞内側にあるTIRドメインにアダプター分子であるMyD88が結合する。MyD88はデスドメインを介してIRAKに結合してこれを活性化し、TRAF6をリン酸化する。このTRAF6がMAPKKK(MAPキナーゼキナーゼキナーゼ)であるTAK1を活性化するので、MAPキナーゼ経路の活性化やNF-κBの活性化を導く。あるいは、TLR4は同じくTIRドメインを介してTRIFを活性化しインターフェロンの制御因子であるIRF3を活性化する。 このように、NF-κBやIRFといった転写因子を発現することで、活性化したマクロファージなどはIFN-γやTNF-αといったサイトカインを分泌する一方、樹状細胞ではCCR7というケモカイン受容体の発現を強めてケモカインCCL21に対する感受性を高める。ここにケモカインがくるとMHC クラスI・II分子や補助刺激分子B7[要曖昧さ回避](CD80・CD86)の発現が誘導される。 機能TLR4はB細胞において、T細胞に依存しない活性化を行うことができる。すなわち、通常のB細胞は抗原のペプチド断片を認識したT細胞によって同じ抗原を認識するB細胞が活性化されるのであるが、リポ多糖に結合できるBCR(B細胞受容体)をもつB細胞(すなわち、リポ多糖を抗原として認識できてそれに対する抗体を作りえるB細胞)のTLR4にリポ多糖が結合すると、BCRとTLR4の両方からシグナルが入り増殖・分化が促される(このとき、リポ多糖に結合できるBCRを持たないB細胞はあまり活性化しない)。しかし、細菌の大量死により多量のリポ多糖が放出されると、リポ多糖に結合できるBCRを持たないB細胞も活性化されるので、過剰なサイトカイン(TNF-αなど)の放出などの免疫系の錯乱が起こる。これがひどい場合には細菌性ショック(敗血症)を起こす。 TLR4を標的とした薬剤LPSの構成成分リピドAのアナログであるエリトランは、TLR4のアンタゴニストであり敗血症の治療薬として治験が行われている[1][2]。 脚注
参考文献
|
Portal di Ensiklopedia Dunia