Main chain or
Backbone That linear chain to which all other chains, long or short or both,
may be regarded as being pendant.
Note : Where two or more chains [ 1]
主鎖 またはバックボーン
注: 2つ以上の鎖が等しく主鎖であると見なすことができる場合、
高分子化学 の分野では、重合体 の主鎖 (しゅさ、英 : main chain )またはバックボーン (英 : backbone chain )とは、共有結合 した原子の最も長い系列であり、それらが一体となって分子 の連続鎖を形成する。この学問は、炭素 骨格からなる有機高分子と、典型元素 のみを含む骨格からなる無機高分子 (英語版 )
生物学的主鎖の一例(ポリペプチド ) 生化学 の分野では、有機主鎖 が高分子 の一次構造 を構成している。この生体高分子 の主鎖は、共有結合した原子の中心鎖で構成されている。主鎖を構成するモノマー 残基の特徴と順序は、生体高分子の複雑な構造の「地図」を作り上げる(参照 核酸構造 、タンパク質構造 )。したがって、主鎖は生体分子の機能に直接関係している。体内の高分子は、大きく分けて、タンパク質 、糖質 、脂質 、核酸 の4つのサブカテゴリーに分類され、それぞれが非常に異なる重要な生物学的プロセスに関与している[ 2] グリセロール であり、より長い置換基を持つ「側鎖 」を持っているため、真の生物学的ポリマーではない。このため、タンパク質、糖質、および核酸のみを高分子骨格を持つ生体高分子と見なす必要がある[ 3]
主鎖の特徴は、重合 の種類によって異なる。段階成長重合 では、モノマー 部分が主鎖になるため、主鎖は一般的に機能的である。これらには、有機半導体 のポリチオフェン や低バンドギャップポリマーが含まれる[ 4] アルケン に適用される連鎖成長重合 では、主鎖は機能的ではなく、機能的な側鎖 またはペンダント基 (英語版 )
主鎖の特性、すなわちその柔軟性は、ポリマーの熱的特性(ガラス転移 温度など)を決定する。たとえば、ポリシロキサン (シリコーン)では、主鎖が非常に柔軟であるため、ガラス転移温度が-123℃(-189°F; 150K)と非常に低くなる[ 5] 薄膜 や溶液 中で結晶化 しやすい傾向がある(例 ポリチオフェン )。次に結晶化は、ポリマーの光学特性、その光学バンドギャップ 、および電子レベルに影響を与える[ 6]
生体高分子 骨格の特性には、いくつかの類似点と多くの相違点がある。タンパク質、炭水化物、および核酸の3つの生体高分子の骨格は、それぞれ最終の縮合反応 によって形成される。縮合反応では、モノマーが共有結合するとともに、何らかの小分子、最も一般的には水分子が失われる[ 7] ヘテロポリマー と、1つのモノマーが繰り返しているホモポリマーの2つに分けられる。一般に、ポリペプチドや核酸 はヘテロポリマーであることが多く、グリコーゲン などの一般的な炭水化物高分子はホモポリマーであることが多い。これは、ペプチドやヌクレオチドのモノマーの化学的な違いがポリマーの生物学的な機能を決定付けるのに対し、一般的な炭水化物モノマーは、エネルギー貯蔵や送達などの1つの一般的な機能を持っているからである。
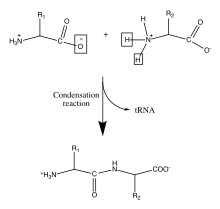
ポリペプチド骨格を形成する2つのアミノ酸 間の単純化された縮合反応 。これは、tRNA の遊離を含む複雑な触媒機構によって、リボソーム 内で行われる。
タンパク質 (proteins)は重要な生体分子であり、ウイルス 、細菌 、真核細胞 の構造や機能に不可欠な役割を果たしている。その骨格は、20種類のアミノ酸 のそれぞれのα炭素に結合したアミノ基 とカルボン酸基 が重合してできたアミド結合を特徴としている。これらのアミノ酸配列は、細胞質 内のリボソーム によって細胞内のmRNA から翻訳される[ 9] 翻訳 と呼ばれる生物学的プロセス中に起こる。この酵素のメカニズムでは、共有結合したtRNA シャトルが縮合反応の脱離基として機能する。新たに遊離したtRNAは、別のペプチドを「拾い上げ」、この反応に継続的に関与することができる[ 10] 一次構造 として知られている。この一次構造を経て、タンパク質はバックボーンのカルボニル酸素とアミン水素の間の水素結合によって形成される二次構造 へと折りたたまれる。個々のアミノ酸残基間のさらなる相互作用により、タンパク質の三次構造 が形成される。そのため、ポリペプチド骨格に含まれるアミノ酸の一次構造はタンパク質の最終的な構造の「地図」であり、その生物学的機能を示している[ 11] [ 2] [ 12]
αとβの分類を示す縮合反応の簡略化された例。グルコース とフルクトース はスクロース を形成する。体内でのグリコーゲンの合成は、ウリジン二リン酸 (UDP)脱離基を使用するグリコーゲン合成酵素 によって行われる。
炭水化物(carbohydrates、糖質とも)は、構造単位、酵素補因子 、細胞表面認識部位 として機能するなど、体内で多くの役割を果たしている。それらの最も一般的な役割は、細胞の代謝経路 におけるエネルギー貯蔵と送達にある。最も単純な炭水化物は、体内のエネルギー送達分子であるグルコース のような単糖 と呼ばれる単糖残基である。オリゴ糖 (最大10残基)や多糖 (最大約50,000残基)は、グリコシド結合 と呼ばれるエーテル結合を特徴とする糖残基が骨格鎖に結合して構成されている。エネルギー貯蔵ポリマーであるグリコーゲンが体内で生成される際に、このグリコシド結合 はグリコーゲン合成酵素 によって形成される。この酵素の働きによる縮合反応のメカニズムは十分に研究されていないが、ウリジン二リン酸グルコース (UDP)分子が中間的リンカーとして働き、合成時に失われることが知られている[ 13] アノマー 炭素(または最も酸化 された炭素)の相対的な立体化学 に応じて、αまたはβ と指定される。フィッシャー投影 では、グリコシド結合が一般的な生物学的糖類の炭素6と同じ側または面にある場合、その糖類はβと指定され、結合が反対側にある場合はαと指定される。伝統的な「椅子構造 」の投影では、連結部が炭素6と同じ平面(赤道または軸方向)にある場合はβ、反対側の平面にある場合はαと指定される。この例示として、スクロース (テーブルシュガー)には、グルコースのα、フルクトース のβという結合がある。一般的に、体内で分解される糖質はα結合であり(例 グリコーゲン )、構造的な機能を持つ糖質はβ結合である(例 セルロース )[ 2] [ 14]
アデニン とグアニン が縮合してホスホジエステル結合 を形成し、核酸骨格の基礎となる。ヌクレオシド三リン酸リボース が近づくと、ポリマーの3'ヒドロキシ基 が攻撃し、ピロリン酸 が放出される。デオキシリボ核酸 (DNA)とリボ核酸 (RNA)は、すべての細胞タンパク質 の産生をコードしているため、非常に重要である。それらはヌクレオチド と呼ばれるモノマーで構成されており、有機塩基 (A 、G 、C 、T またはU )、ペントース糖 、およびリン酸基 からなる。それらは、リボース 糖の3'炭素がリン酸基とホスホジエステル結合 で結合している骨格を持つ。この結合は、ポリメラーゼ と呼ばれる細胞酵素の助けを借りて形成される。この酵素の働きによる縮合反応では、入ってくるすべてのヌクレオチドは、ピロリン酸 基を失って固有のホスホジエステル結合を形成する三リン酸リボース を持っている。この反応は、ピロリン酸の放出に伴う大きな負の自由エネルギー 変化によって引き起こされる。また、核酸骨格の塩基配列は一次構造としても知られている。核酸は何百万ヌクレオチドの長さになる可能性があるので、生命の遺伝的多様性 をもたらしている。塩基は、DNAのペントースリン酸ポリマー骨格から突き出ており、それらの相補的パートナーとペアで水素結合 している(AとT、GとC)。これにより、両側にペントースリン酸骨格を持つ二重らせん が作成され、二次構造が形成される[ 15] [ 2] [ 16]
^ IUPAC , Compendium of Chemical Terminology , 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "main chain (backbone) of a polymer ".^ a b c d Voet, Donald; Voet, Judith G.; Pratt, Charlotte W. (2016). Fundamentals of Biochemistry: Life at the Molecular Level ISBN 978-1-118-91840-1 . https://books.google.com/books?id=9T7hCgAAQBAJ
^ Cox RA, García-Palmieri MR (1990). “31 Cholesterol, Triglycerides, and Associated Lipoproteins” . Clinical Methods: The History, Physical, and Laboratory Examinations ISBN 0-409-90077-X . PMID 21250192 . NBK351. https://www.ncbi.nlm.nih.gov/books/NBK351/ ^ Budgaard, Eva; Krebs, Frederik (2006). “Low band gap polymers for organic photovoltaics”. Solar Energy Materials and Solar Cells 91 (11): 954–985. doi :10.1016/j.solmat.2007.01.015 . ^ “Polymers ”. 2015年10月2日時点のオリジナル よりアーカイブ。2015年9月17日 閲覧。 ^ Brabec, C.J.; Winder, C.; Scharber, M.C; Sarıçiftçi, S.N. ; Hummelen, J.C.; Svensson, M.; Andersson, M.R. (2001). “Influence of disorder on the photoinduced excitations in phenyl substituted polythiophenes” . Journal of Chemical Physics 115 (15): 7235. Bibcode : 2001JChPh.115.7235B . doi :10.1063/1.1404984 . https://pure.rug.nl/ws/files/6636890/2001BrabecJChemPhys.pdf . ^ IUPAC , Compendium of Chemical Terminology , 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "condensation reaction ".^ Hirsch, Andreas (1993). “Fullerene polymers”. Advanced Materials 5 (11): 859–861. doi :10.1002/adma.19930051116 . ^ Noller, HF (2017). “The parable of the caveman and the Ferrari: protein synthesis and the RNA world” . Phil. Trans. R. Soc. B 372 (1716): 20160187. doi :10.1098/rstb.2016.0187 . PMC 5311931 . PMID 28138073 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5311931/ . ^ Weinger, Joshua (2006). “Participation of the tRNA A76 hydroxyl groups throughout translation” . Biochemistry 45 (19): 5939–5948. doi :10.1021/bi060183n . PMC 2522371 . PMID 16681365 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2522371/ . ^ Berg JM, Tymoczko JL, Stryer L (2002). “3.2 Primary Structure: Amino Acids Are Linked by Peptide Bonds to Form Polypeptide Chains” . Biochemistry ISBN 0-7167-3051-0 . NBK22364. https://www.ncbi.nlm.nih.gov/books/NBK22364/ ^ Badaczewska-Dawid, Aleksandra E.; Kolinski, Andrzej; Kmiecik, Sebastian (2020). “Computational reconstruction of atomistic protein structures from coarse-grained models” . Computational and Structural Biotechnology Journal 18 : 162–176. doi :10.1016/j.csbj.2019.12.007 . ISSN 2001-0370 . PMC 6961067 . PMID 31969975 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6961067/ . ^ Buschiazzo, Alejandro (2004). “Crystal structure of glycogen synthase: homologous enzymes catalyze glycogen synthesis and degradation” . The EMBO Journal 23 (16): 3196–3205. doi :10.1038/sj.emboj.7600324 . PMC 514502 . PMID 15272305 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC514502/ . ^ Bertozzi CR, Rabuka D (2009). “Structural Basis of Glycan Diversity” . Essentials of Glycobiology ISBN 9780879697709 . PMID 20301274 . https://www.ncbi.nlm.nih.gov/books/NBK1955/ ^ Alberts B, Johnson A, Lewis J, et al (2002). “DNA Replication Mechanisms” . Molecular Biology of the Cell ISBN 0-8153-3218-1 . NBK26850. https://www.ncbi.nlm.nih.gov/books/NBK26850/ ^ Lodish H, Berk A, Zipursky SL, et al (2000). “4.1, Structure of Nucleic Acids” . Molecular Cell Biology ISBN 0-7167-3136-3 . NBK21514. https://www.ncbi.nlm.nih.gov/books/NBK21514/