|
ユビキチン結合酵素
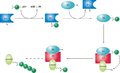
ユビキチン結合酵素(ユビキチンけつごうこうそ、英: ubiquitin-conjugating enzyme)はE2酵素(E2 enzyme)としても知られ、タンパク質をプロテアソームを介した分解の標的とするユビキチン化反応の2番目の段階を担う。稀にubiquitin-carrier enzymeと呼ばれることもある。ユビキチン化は、標的タンパク質のリジン残基へ、76アミノ酸の小さなタンパク質ユビキチンを共有結合によって接着する過程である。タンパク質に対して1つのユビキチン分子によるタグ付けがなされると、さらなるユビキチン化によってポリユビキチン鎖が形成される。ポリユビキチン鎖はプロテアソームの19S調節粒子によって認識され、ATP依存的な標的タンパク質のアンフォールディングが引き起こされる。それによってポリペプチド鎖はプロテアソームの20Sコア粒子を通過できるようになり、そこでプロテアーゼが標的タンパク質を短いペプチド断片へ分解し、リサイクルされる。 ユビキチンシステムユビキチン活性化酵素(E1)はまず、活性部位のシステイン残基にユビキチンを共有結合させることでユビキチンを活性化する。活性化されたユビキチンはその後、ユビキチン結合酵素(E2)のシステイン残基へ転移される。ユビキチンが結合すると、E2分子はいくつかのユビキチンリガーゼ(E3)のうちの1つへ、構造的に保存された結合領域を介して結合する。E3分子は基質となる標的タンパク質への結合と、E2のシステインから標的タンパク質のリジン残基へのユビキチンの転移を担う[1]。
特定の細胞は通常わずかな種類のE1分子のみを持っているのに対し、E2分子の多様性はより大きく、E3分子の多様性は極めて大きい。そのため、基質の特定と結合を担うE3分子が、プロテアソーム分解の基質特異性を与える機構である。E2の各タイプはそれぞれ多くのタイプのE3と結合する[2]。 アイソザイム次に挙げるヒトの遺伝子はユビキチン結合酵素をコードしている。
出典
関連項目外部リンク |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia