|
ホモゲンチジン酸-1,2-ジオキシゲナーゼ
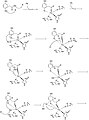
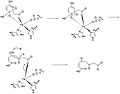
ホモゲンチジン酸-1,2-ジオキシゲナーゼ (homogentisate 1,2-dioxygenase, HGD) は、ホモゲンチジン酸を4-マレイルアセト酢酸に変換する酵素である。HGDは芳香環の異化に関連する酵素で、チロシンとフェニルアラニンの分解に特異的であり[1]、それぞれの代謝経路を構成している。基質であるホモゲンチジン酸も生成物である4-マレイルアセト酢酸も代謝経路に用いられる。HGDはホモゲンチジン酸の芳香環を開裂させるためにFe2+とO2を必要とする[2]。 活性部位ホモゲンチジン酸-1,2-ジオキシゲナーゼの活性部位はTitusらの研究によりその結晶構造から究明されている[1]。活性部位の結晶構造ではHis292, His335, His365, His371, および Glu341のそれぞれのアミノ酸残基が見られる。  ホモゲンチジン酸はFe2+原子を仲介に活性部位のGlu341, His335, および His371の部分に結合する。ここでHis292は芳香環のヒドロキシル基に結合する。His365はGlu341に水素結合で結合することによりアミノ酸側鎖が安定する。 反応機構Borowskiらは米国化学会誌においてHGDの反応機構を提唱している。彼らは反応機構をGAUSSIANとJaguarのプログラムを用い、DFT法(B3LYP)によって演算を行った[2]。 ホモゲンチジン酸の芳香環の開裂は多段階からなり、まずFe2+がカルボニル基とオルトフェノール酸素に配位する。鉄原子はこの他にHis335, His371, および Glu341にも配位している。これに酸素分子が鉄原子に結合し[2]、芳香環はペルオキソ架橋中間体に変化する。酸素分子は開裂しエポキシドを形成する。このエポキシド中間体はラジカル反応により開裂し、六員環は酸化される。
脚注
外部リンク |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia