|
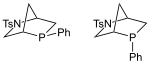
ホスフィン配位子 ホスフィン配位子(ホスフィンはいいし、英: Phosphine ligand)はホスフィン類化合物であり、一般式はPRR'R"(R, R', R" = H、アルキル、アリール等)と表される。特に有機金属化学において均一系触媒となる金属錯体の配位子として用いられることが多いが、それ以外の分野でも使われている[1]。 典型的な配位子ホスフィン配位子としてもっともありふれているのはトリアルキルホスフィンPR3である。ホスフィンの水素原子の代わりに3つの同じアルキル基が結合している。頻繁に見られる配位子としてはトリフェニルホスフィンとトリメチルホスフィンがある。トリアリールホスフィンは多くの場合安定な白色固体であるが、トリアルキルホスフィンは無色の液体で空気中で容易に酸化されてホスフィンオキシド (R3PO) に変化する。この配位子は電子供与性と立体的嵩高さによって分類される。これらはそれぞれトールマンの電子パラメータ、配位子円錐角と呼ばれる。一般的なアルキルホスフィンは強い塩基であり、σ供与性が高い。 キレートホスフィン二座配位子→詳細は「ジホスフィン」を参照
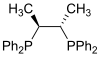
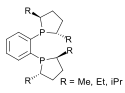
一般的な二座配位子はdppe、dmpeなどがある。一般式はR2PCH2CH2PR2(RはそれぞれPh、Me)である。 三座配位子三座配位トリホスフィンは2種類に分類され、直線型と三点架橋型がある。これらの配位子はどちらもtriphosと呼ばれる。フェニル置換された配位子の化学式はそれぞれCH3C(CH2PPh2)3とPhP(CH2CH2PPh2)2である。 四座配位子三点架橋型ホスフィン四座配位子にはトリス[2-(ジフェニルホスフィノ)エチル]ホスフィン(pp3)がある[2]。 キラルホスフィン配位子キラルホスフィン配位子には2種類が存在し、これらが不斉水素化などの不斉触媒として研究されている。キラルなジホスフィンが一般的に利用されている。DIPAMPなどのP-キラルホスフィンは3つの異なる置換基が1つのリン原子に結合している。BINAPはアトロプ異性体のためにキラル錯体を生成するC2-対称ジホスフィンの例である。
脚注
関連項目 |
||||||||||||||||||||
Portal di Ensiklopedia Dunia