|
アブシンチン
(+)-アブシンチン(Absinthin)はニガヨモギ(Artemisia absinthium)に含まれる天然有機化合物である。アブシンチンはニガヨモギで香りをつけたリキュールアブサン (absinthe) の特徴的な味の元となる最も苦い物質の中の一つである[1]。本化合物は生理活性を示し、抗炎症薬として期待されている[2]。アブサンに含まれる精神活性毒であるツヨンと混同してはならない。 化学構造アブシンチン (1) の複雑な構造はセスキテルペンラクトンに分類される。テルペノイドは、イソプレン (4) 由来の炭素数5のビルディングブロック (3) から構築される天然物の大きな分類である。この複雑な構造は、2つの同一なモノマー(2)が、グアイアノリドの5員環とアルケンとのディールス・アルダー反応によって構築される。 アブシンチンは1953年に単離され[3][4]、1980年にBeauhaireらによって構造決定された[5][6][7][8]。 全合成(+)-アブシンチンの全合成は2004年にZhangらによって達成された[9]。この合成は、市販のサントニン (Santonin) を出発原料として、計10段階、総収率18.6%だった。この合成の基盤は、原料の6員環の7員環への環拡大によるグアイアノリドモノマー (2) 骨格の構築であり、続くディールス・アルダーカップリング (3) および最終段階の立体配置の改変によって (+)-アブシンチン (4) が得られた。  生合成アブシンチンのニガヨモギにおける生合成の全経路は明らかにされていないが、その大部分はアブシンチン生合成に必要な前駆体から推測可能である。アブシンチンの様なテルペノイドはイソプレン単位から構成されている(イソプレンそのものが反応するわけではなく、イソペンテニル二リン酸の形で使われる)。テルペンの命名法が示すように、アブシンチンの最初の前駆体であるファルネシル二リン酸 [A] は炭素数15(イソプレン単位3)である。このジホスフェート (1) はカルボカチオンを酵素内で発生させ (1)、分子内の末端と炭素-炭素結合を形成し環化する (2)。ヨモギ属における生合成経路での最初の安定な中間体はゲルマクレンA (Germacrene A) [B] と考えられている。ゲルマクレンAは植物セスキテルペン合成経路においてグアイアノリドの前駆体であることが以前同定されている[10]。ここから、ヒドロキシル化 (3)、アルデヒドへの酸化 (4)、さらなるヒドロキシル化 (5)、そしてカルボキシル基の形成が起こる。ここで (4) の後、末端の炭素-炭素二重結合が消失していることが重要である。この二重結合が失われたことによって、アブシンチンモノマーが得られるか他のゲルマクレンAの下流の化合物が得られるかが決まる。この還元は (4) の段階で起こる必要はなく、もっと後でもよい。次に、一般的なグアイアノリド経路で提唱されているように、カルボキシル基とヒドロキシル基との脱水縮合反応 (7) によりγ-ラクトン [C] が合成される[11]。ヒドロキシル化と二重結合の異性化 (8,9) によるアブシンチンセスキテルペングアイアノリドモノマー [D] の形成は、ディールス・アルダー反応 (10) による二量化でのアブシンチン [E] の合成に必要である。このディールス・アルダー反応は自発的によい収率で起こるが、関連合成酵素により促進されていると思われる[9]。にもかかわらず、典型的な天然物の生合成に比べて遅い。 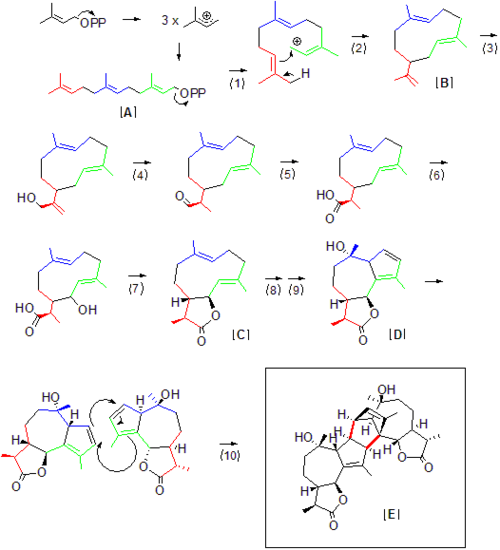 In vitroでこのセスキテルペンの合成を再現できるニガヨモギに特異的な酵素はまだ単離されていないが、上に示された反応経路はセスキテルペンラクトンであるゲルマクレンAの生合成経路における中間体を用いて推定されている。上記の反応経路の各番号に相当するテルペン生合成酵素は以下の通りである:
脚注
|
||||||||||||||||||||||||
Portal di Ensiklopedia Dunia

